Valvuläre Herzerkrankungen
Aortenklappenstenose (AS)
Degenerative, rheumatische oder kongenitale Verengungen der Aortenklappe mit Obstruktion des Blutflusses aus dem linken Ventrikel in die Aorta.
- Prävalenz: steigt mit Alter (2–7% bei Bevölkerung > 65 Jahre; 12% > 75 Jahre)
- Ätiologie: v.a. Degeneration (80%), insbesondere bei bikuspiden Klappen (1–2% der Bevölkerung)
Prognose
- Asymptomatisch (bei älteren Patienten schwierig zu erfassen, siehe Diagnostik): jährliche Inzidenz des plötzlichen Herztodes < 1%.
- Ereignisfreies Überleben innert 2 Jahren nur 20–50%! Sobald symptomatisch jährliche Inzidenz des plötzlichen Herztodes 8–34% und 5-Jahres-Überleben 15–50%.
- Die Mortalität unter medikamentöser Therapie bei inoperabler, symptomatischer, schwerer Aortenstenose lag im PARTNER Trial bei 50% innerhalb eines Jahres.
Diagnostik
- Anamnese: belastungsinduzierte Symptome wie Dyspnoe (NYHA I-IV), Angina Pectoris (CCS I-IV), Schwindel und Synkopen unter Belastung. Im Alter oft unspezifische Symptome wie Ermüdbarkeit und Zeichen der Herzinsuffizienz. Schwierige Anamnese bei (multimorbiden) Patienten mit geringer körperlicher Aktivität/Vermeidungsverhalten (s.u.).
- Klinische Befunde: raues mid- bis spätsystolisches Crescendo-decrescendo-Geräusch mit p.m. im 2. ICR rechts, fortleitend in die Carotiden (Lautstärke des Geräusches korreliert nicht mit dem Stenosegrad). 2. Herzton bei schwerer AS oft fehlend (oft in Kombination mit einem pulsus parvus et tardus).
Apparative Untersuchungen
- EKG: > 80% unspezifisch, linksventrikuläre Hypertrophie
- Transthorakale Echokardiografie (TTE): i.d.R. ausreichend zur Erfassung des Schweregrades der AS (Beurteilung der linksventrikulären Funktion [biplane EF, globaler longitudinaler strain, 3D EF], Aorta, andere Vitien, Hinweise auf pulmonale Drucksteigerung). Eine genaue Quantifizierung (nicht Schätzung) des Stenosegrades ist für den Langzeitverlauf notwendig.
Echokardiographische Kriterien schwere Aortenklappenstenose
| Klappenöffnungsfläche (KÖF) | Indexierte KÖF | Mittlerer Druckgradient | Maximale Spitzengeschwindigkeit | Verhältnis Geschwindigkeitsintegral (AK/LVOT) |
| < 1.0 cm² | < 0.6 cm²/m² | > 40 mmHg | > 4 m/s | < 0.25 |
- Belastungstest mittels Ergometrie oder Laufbandbelastung: Bei asymptomatischen Patienten zur Objektivierung der Belastbarkeit. Blutdruckanstieg bzw. pathologischer Blutdruckabfall?
- Dobutamin Stress-Echokardiografie: Bei eingeschränkter linksventrikulärer Funktion mit niedrigen Gradienten zum Unterscheiden zwischen «low-flow, low-gradient»- und «paradoxical low-flow, low-gradient»-Aortenstenose (chirurgische Mortalität bei ersterer 5%, bei letzterer ca. 32%)
- Transösophageale Echokardiografie (TEE): Bei inkonklusiven TTE-Befunden zur Beurteilung der Klappenmorphologie/Planimetrie. Planung vor perkutaner Aortenklappenimplantation (TAVI): 3D bei Niereninsuffizienz alternativ zur CT-Diagnostik (Annulusgrösse).
- Koronarangiografie: Präoperativ Ausschluss/Nachweis einer relevanten Koronaren Herzerkrankung. Simultaner Druckmessung im linken Ventrikel und Aorta zur Quantifizierung der AS.
- Multislice Angio CT: Methode der Wahl präoperativ vor TAVI/minimal invasivem Klappenersatz: Exakte Morphologie/Verkalkung der Aortenklappe, Abstandmessung Annulus-Koronarostien, Annulusgrösse und Darstellung Aorta/arterielle Zugangswege (subclavia, femoral, aortal): Kanülierungsstellen, Aortenverkalkung.
Wie häufig kontrollieren? Welche Parameter zur Verlaufskontrolle?
- Leichte AS: bei jüngeren Patienten mit leichter Stenose ohne wesentliche Verkalkung 3- bis 5-jährlich Echokardiografie und Ergometrie
- Mittelschwere AS: alle 1–2 Jahre. «Mittelschwer» kann immer auch eine unterschätzte «schwere» Aortenklappenstenose sein.
- Schwere AS, asymptomatisch: alle 6 Monate – jährlich mit Frage nach Neu-Auftreten von Symptomen, ggf. Ergometrie und Echokardiografie mit Frage nach Befundänderung, insbesondere der linksventrikulären Funktion.
- NT-pro BNP zur Verlaufskontrolle. Bei Risikofaktoren (Verkalkung, rascher Gradientenanstieg) oder Malcompliance Intervalle individuell verkürzen.
Therapie
- Die schwere AS ist kausal medikamentös nicht therapierbar!
Medikamentöse Therapie
- Nur Palliation oder kurzfristige Behandlung der Herzinsuffizienz vor AKE oder TAVI: Diuretika, (CAVE: Vermeidung von Hypotonien bei ACE- Hemmer oder Angiotensin-Rezeptor-Blocker, Spironolacton). Keine negativ inotropen Substanzen verwenden.
Chirurgischer Aortenklappenersatz (AKE)
- Früher alternativloser konventioneller Standard unter Verwendung der Herz-Lungen-Maschine. Minimal invasiver Zugangsweg von rechts parasternal oder mittels Hemi-Sternotomie möglich.
- Resektion und Ersatz der nativen Klappe durch eine mechanische (jüngere Patienten < 50 Jahre; IIa C; keine KI für OAK) oder biologische (ältere Patienten > 65 Jahre; IIa C) Prothese. Bei 50–65 Jahre individuelle Entscheidung (IIa C): Die Wahl der Prothese basiert auf der Einnahme lebenslanger oraler Antikoagulation (OAK) versus Degeneration der implantierten Klappe (biologisch). Die Entscheidung basiert auf dem Wunsch des aufgeklärten Patienten nach Diskussion im Herzteam (Herzteam: Invasiver Kardiologe, Herzchirurg, kardiovaskulärer Imaging-Spezialist, fakultativ Intensivmediziner, Anästhesist, Hausarzt, Internist und Geriater).
- Beim älteren Patienten > 80 Jahre oder jüngere Patienten mit Lebenserwartung < 10 Jahre: chirurgischer Klappenersatz nur bei Kontraindikation für eine transfemorale perkutane Klappenimplantation (I A).
- Zwischen 65 und 80 Jahren ohne Kontraindikationen für transfemoralen Zugang: chirurgischer oder perkutaner Klappenersatz sind gleichwertig nach Diskussion der Lebenserwartung des Patienten und der Haltbarkeit der Herzklappe anzubieten (I A).
Perkutane Aortenklappenimplantation (TAVI, Katheter-basiert)
Biologischer interventioneller Aortenklappenersatz, initial für inoperable Patienten entwickelt. Aufgrund der guten 1–5 Jahresdaten zeichnet sich hier ein Paradigmenwechsel hin zu einem neuen «Gold-Standard» ab; fehlende Langzeitdaten hinsichtlich der Haltbarkeit. Die Diskussion im Herzteam unter Berücksichtigung vieler individueller Faktoren ist obligatorisch.
- In Lokalanästhesie ohne Herz-Lungen-Maschine mit arteriellen Zugangsmöglichkeiten femoral und via A. subclavia; in Narkose auch transapical oder direkt aortal.
- Bei hohem, intermediärem und neu auch bei niedrigem operativem Risiko für AKE mit Indikation zum biologischen Klappenersatz bei Erfüllung der anatomischen Kriterien im Bereich der Aortenwurzel und gutem transfemoralem Zugangsweg (TAVI-CT).
- Die Diskussion im Herzteam ermöglicht die Berücksichtigung individueller Faktoren und trägt der rasanten Entwicklung für die Therapieentscheidung Rechnung.
Ballonvalvuloplastie
Nur noch bei Hochrisikopatienten mit akuter hämodynamischer Instabilität in Ausnahmefällen als Überbrückung vor AKE oder TAVI (IIb C). Gefahr der relevanten, hämodynamisch kaum tolerierbaren, akuten schweren Klappeninsuffizienz. Daher kaum noch angewendet.
Präoperative Risikostratifizierung
Zwei Score-Systeme: der US-amerikanische STS Score (http://riskcalc.sts.org) und der Europäische EuroSCORE II (www.euroscore.org/calc) werden zur Einschätzung der perioperativen Morbidität und Mortalität herangezogen (STS = Society of Thoracic Surgeons). Die Scores sind abgeleitet aus Datenbanken des chirurgischen Klappenersatzes (AKE) und ungeeignet, um das individuelle Risiko eines perkutanen Klappeneingriffes (TAVI) zu beurteilen.
Hohes operatives Risiko bei einem STS Score ≥ 10% oder EuroSCORE II ≥ 10%, intermediär STS/EuroSCORE II ≥ 4%.
Individuelle Faktoren wie «Gebrechlichkeit» («Frailty»), Porzellanaorta, intakte Bypässe nach ACVB-OP, thorakale Bestrahlung, Hinweise auf Endokarditis, femorale Zugangswege, erwarteter Patient-/Prothesen-Mismatch, schwere thorakale Deformitäten, Anatomie des Sinus und der Koronarabgänge, Annulusgrösse, Thromben im Ventrikel/Aortal, relevante KHK, Aneurysmata, weitere Klappenerkrankungen etc. müssen bei der Diskussion im Herzteam berücksichtigt werden.
Praktisches Vorgehen bei schwerer Aortenklappenstenose
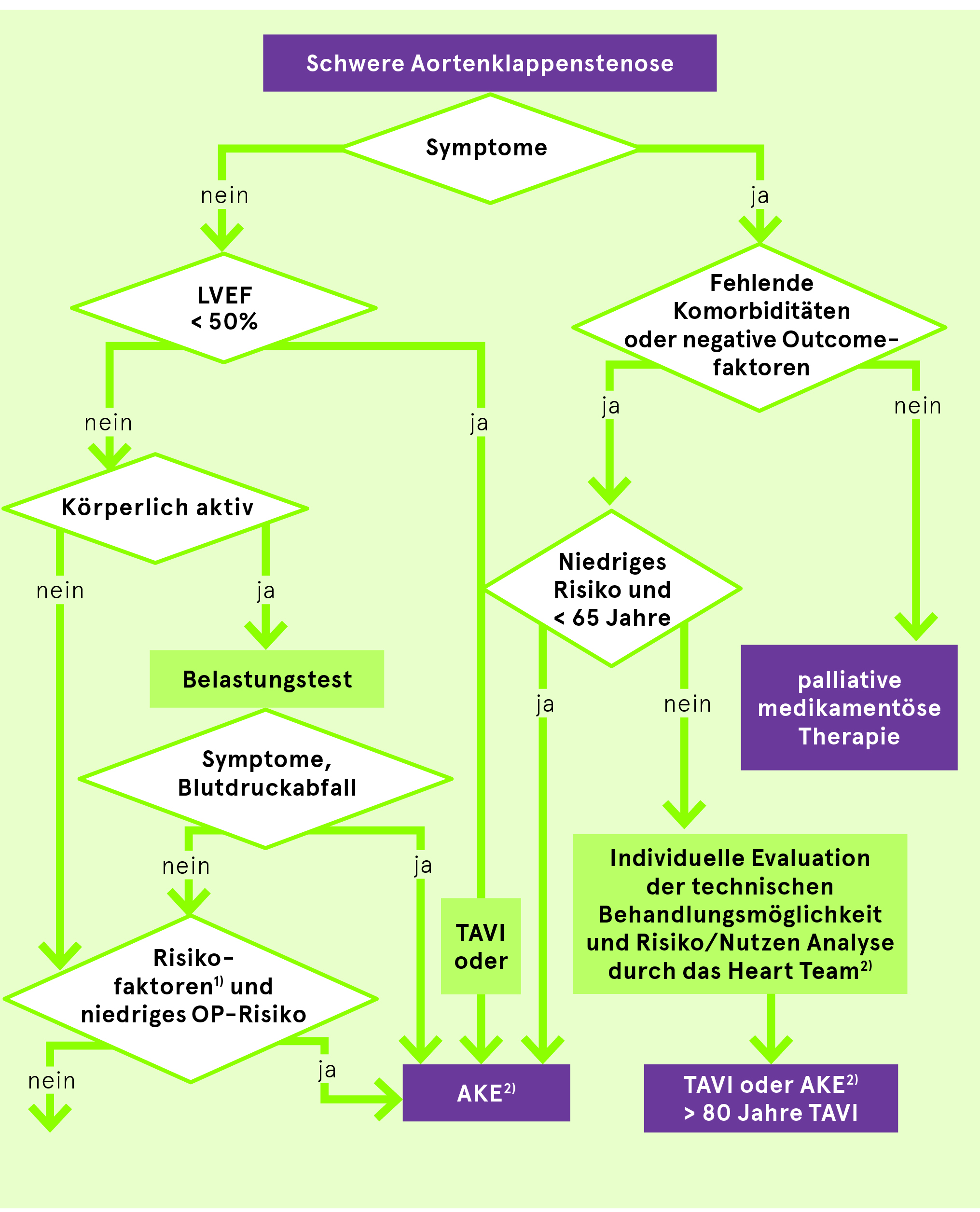
1) OP sollte bei folgenden Risikofaktoren (IIa C) bedacht werden: Spitzengeschwindigkeit > 5.5 m/s, Schwere Verkalkung und Progression der Spitzengeschwindigkeit > 0.3 m/s/Jahr. Kann diskutiert werden (IIa C) bei 3× erhöhtem BNP ohne andere Erklärung.
2) Die Entscheidung soll im «Herzteam» aufgrund individueller klinischer Charakteristika und Anatomie getroffen werden.
Nach: Richtlinien Management von Herzklappenerkrankungen ESC 2017, AHA/ACC 2020
Aortenklappeninsuffizienz (AI)
Ist entweder Folge einer Läsion der Klappentasche oder eine Erkrankung der Aortenwurzel/bzw. des Aortenklappenannulus
- Akut: bei Endokarditis, Typ A Dissektion der Aorta oder traumatisch
- Chronisch: bei bikuspiden Aortenklappen, Dilatation des Aortenklappenannulus oder des Aortensinus (z.B. Marfan-Syndrom)
Prognose
- Leichte bis mittelschwere asymptomatische AI: gute Prognose, d.h. jährliche Mortalität ca. 1%
- Schwere asymptomatische AI: niedrige Mortalität, jedoch bei schwerer LV Dilatation (LVESD > 50 mm) beträgt die Wahrscheinlichkeit für Herzinsuffizienz und Tod 19% pro Jahr
- Schwere symptomatische AI: jährliche Mortalität ca. 10–20%
- Akute AI: hohe Mortalität
Diagnostik
- Anamnese: Belastungsdyspnoe und/oder Angina pectoris, Palpitationen und Synkopen.
- Klinische Befunde: Hohe Blutdruckamplitude, arterielle Pulsationen. Auskultatorisch diastolisches Geräusch mit Decrescendo-Charakteristik (vorgebeugt im Sitzen auskultieren). Meist auch systolisches Austreibungsgeräusch (Pendelvolumen). Bei akuter AI ist das Geräusch kurz und v.a. bei Lungenödem schwierig zu diskriminieren!
Apparative Untersuchungen
- Transthorakale Echokardiografie (TTE): Semiquantitative Erfassung des Schweregrades der AI, (OP-relevante) zusätzliche Befunde: LV-Auswurfsfraktion (EF) und Grösse (Volumen multiplanar oder 3D), aortale Dimensionen und begleitende Vitien.
- Transösophageale Echokardiografie (TEE): Insbesondere zur exakten morphologischen Beurteilung der Klappe angezeigt. Zusätzlich kann die Aorta beurteilt werden. Als Alternative zum CT und MRI bei Niereninsuffizienz.
- Koronarangiografie/Rechtsherzkatheter: Präoperativ bei Patienten > 40 Jahre mit mittlerem-hohen kardiovaskulärem Risiko zum Ausschluss/Nachweis einer relevanten KHK. Semiquantitative Graduierung der AI, Abklärung prä-/postkapilläre pulmonale Hypertonie
- CT und MRI: Beurteilung des gesamten aortalen Gefässbaumes, insbesondere bei seltenen Ursachen (Marfan, Vaskulitiden unterschiedlicher Genese, Lues). CT als Alternative zur Koronarangiografie bei jungen Patienten bei niedrigem kardiovaskulärem Risiko ausreichend.
Therapie/Follow-up
Asymptomatische Patienten mit leichter AI sollten alle 5 Jahre, mit mittelschwerer AI alle 2 Jahre klinisch als auch echokardiografisch zur Erfassung einer Progression kardiologisch gesehen werden.
Bei Progredienz des Schweregrades oder bei linksventrikulären Dimensionen nahe an den Entscheidungskriterien 6-monatliche Kontrollen. Bei stabilen Messwerten alle 12 Monate.
Konservativ
Leichtgradige, chronische AI: keine Therapie. Jährliche klinische Beurteilung hinsichtlich der Symptomatik (Hausarzt) und 2- bis 5-jährliche echokardiografische Kontrolle. Behandlung einer evtl. arteriellen Hypertonie primär mit Vasodilatatoren, nach Möglichkeit kein Betablocker. Keine Aktivitätseinschränkungen. Bei Progression oder Dilatationen der Aorta/des linken Ventrikels im Bereich der Grenzwerte: 6-monatige Kontrollen mittels Echokardiografie.
Vasodilatatoren (ACE-Hemmer, Angiotensin-Rezeptor-Blocker) kurzfristig bei Patienten mit Herzinsuffizienz vor OP. Bei Patienten mit Marfan-Syndrom (bzw. generell aortaler Dilatation) sind Betablocker und/oder Angiotensin-Rezeptor-Blocker (gute Daten v.a. für Losartan) prä- und postoperativ angezeigt. Bei schwerer AI oder grenzwertigen aortalen Durchmessern keine isometrischen Übungen, Kontaktsportarten, Wettbewerbe oder hohe körperliche Anstrengungen.
OP-Indikationen für chirurgischen Aortenklappenersatz (AKE)
Symptomatische, akute schwere AI: sofortige/dringliche Operation.
Chronische, schwere AI:
- Bei Auftreten von Symptomen (I B)
- Bei asymptomatischen Patienten mit Verschlechterung der linksventrikulären Funktion (EF < 50%; I C) oder Grössenzunahme in seriellen, vergleichbaren Messungen (LVEDD > 70 mm oder LVESD > 50 mm oder > 25 mm/m2 BSA bei kleinen Patienten)
- Diskussion im Herzteam in ausgesuchten Patienten (TEE obligatorisch) mit Eignung für die Klappenreparatur (nicht verkalkt, Aortenwurzelerweiterung oder Prolaps)
- Reparatur ist empfohlen in jungen Patienten mit o.g. Kriterien durch erfahrene Chirurgen (I C)
Praktisches Vorgehen bei schwerer Aortenklappeninsuffizienz
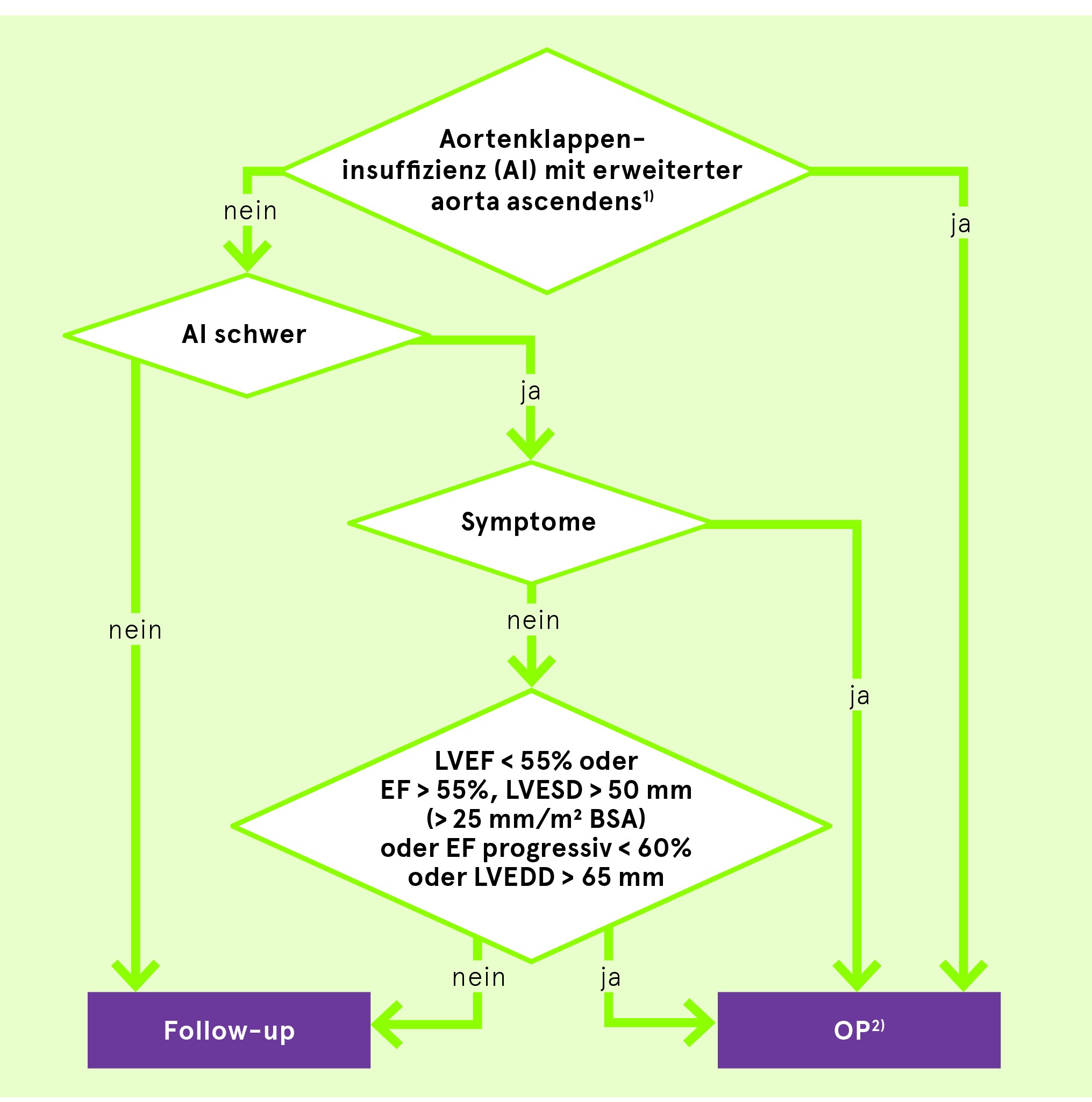
2) Diskussion der OP auch bei signifikanten Änderungen der linksventrikulären oder aortalen Dimensionen während Follow-up.
Nach: Richtlinien Management von Herzklappenerkrankungen ESC 2017 und ACC/AHA 2020
Perkutane Aortenklappenimplantation (TAVI)
- Bei fehlender Verkalkung und hohem Pendelvolumen ist die Verankerung der Prothese problematisch. Bislang limitierte Erfahrungen mit nur 2 dedizierten Klappentypen, keine randomisierten Studien
- Indikationsstellung in spezifischen Fällen im Herzteam unter Berücksichtigung der individuellen Faktoren
Mitralklappeninsuffizienz (MI)
Zweithäufigste Klappenerkrankung in der Allgemeinbevölkerung, die zur OP führt. Prävalenz von mittelschwerer oder schwerer MI: 1.7% in der Normalbevölkerung und 9.3% bei über 75-Jährigen.
Ätiologisch:
- Primär organische MI mit strukturellen/degenerativen Veränderungen der Klappe selbst (Prolaps, «Flail leaflet» bei Sehnenfadenabriss, myxomatöse Veränderungen, rheumatische Erkrankung, Endokarditis, Cleft, Papillarmuskelruptur nach Myokardinfarkt)
- Funktionelle MI bei strukturell normaler Klappe (Annulusdilatation mit «Tethering» der Klappensegel, ischämisch bei Papillarmuskeldysfunktion)
Prognose
Leichte MI: Keine Einschränkung der Lebenserwartung. Die chronische MI wird gut toleriert, bleibt lange asymptomatisch. Bei zunehmender linksventrikulärer Leistungseinschränkung klinische Symptome: Dyspnoe, Herzklopfen (Vorhofflimmern bei Vorhofdilatation), Orthopnoe, nächtliche Hustenanfälle. Die Wahrscheinlichkeit für Tod bzw. kardiale Ereignisse ist abhängig von der Ätiologie der valvulären Dysfunktion. Die asymptomatische schwere MI hat eine 5-Jahres-Wahrscheinlichkeit für kardiale Ereignisse (Tod, Herzinsuffizienz, VHF) von 14–33%. Die schwere symptomatische funktionelle MI (mit oder ohne KHK) sowie die akute schwere MI (Papillarmuskelabriss nach Myokardinfarkt; Sehnenfadenabriss) haben ohne medikamentöse und chirurgische Therapie eine sehr schlechte Prognose.
Diagnostik
- Anamnese: Dyspnoe (NYHA I-IV), Orthopnoe, Palpitationen (Vorhofflimmern). Jedoch: oft jahrelanger, asymptomatischer Verlauf bei chronischer MI!
- Klinische Befunde: Auskultation in Linksseitenlage: unmittelbar nach dem eher leisen ersten Herzton hochfrequentes, bandförmiges Systolikum mit p.m. über der Herzspitze mit Fortleitung in die Axilla
Apparative Untersuchungen
- EKG: p-Mitrale, (paroxysmales) Vorhofflimmern?
- Transthorakale Echokardiografie (TTE): Schweregrad der MI durch Messung des Regurgitationsvolumens, Volumetrie des linken Ventrikels
- Transösophageale Echokardiografie (TEE): Bei diskrepanten Befunden oder nicht optimaler Untersuchungsqualität insbesondere bei V.a. schwere MI, exakte Regurgitationsvolumina mittels 3D-Volumetrie. Präoperativ (vor chirurgischer oder perkutaner Rekonstruktion/Klappeneratz): zur exakten Erfassung der Morphologie (3D-Darstellung der Mitralklappe)
- Physikalische Belastung mit zusätzlicher Echokardiografie auf dem Liegevelo: In unklaren Fällen oder bei dynamischer (ischämischer) MI
- Koronarangiografie/Herzkatheter: Präoperativ zum Ausschluss/Nachweis einer relevanten KHK. Ergänzende Beurteilung des Schweregrades der Mitralinsuffizienz und der Abklärung einer allfälligen begleitenden pulmonalen Hypertonie.
Therapie
Die medikamentöse Therapie der degenerativen MI ist indiziert bei der Entwicklung einer systolischen Dysfunktion. Im Gegensatz dazu ist bei der funktionellen MI die medikamentöse Therapie der Linksherzinsuffizienz der erste Schritt der Behandlung. Das Prinzip ist gleich bei beiden Pathologien und beinhaltet eine Nachlastsenkung mit ACE-Hemmern oder Angiotensin-Rezeptor-Blocker, Betablocker (zu starke Bradykardisierung vermeiden), Diuretika und Aldosteron-Antagonisten. Eskalation auf Sacubitril/Valsartan.
Chirurgische Therapie für funktionelle und degenerative MI
Mitralklappenrekonstruktion (MKR, konventionell oder minimalinvasiv): bei passender Klappenmorphologie Methode der Wahl beim Patienten mit niedrigem operativem Risiko und degenerativer MI. Bei funktioneller MI ist eine Reparatur nicht besser als Klappenersatz. Implantation eines Mitralringes, Segelresektion und Einsatz künstlicher Sehnenfäden. Mitralklappenersatz (MKE, biologisch oder mechanisch): Alternative bei schwer vorgeschädigter nativer Herzklappe, rheumatischer Erkrankung. Mechanische (jüngere Patienten < 65 Jahre; IIa C) oder biologische (ältere Patienten > 70 Jahre; IIa C) Prothese. Die Wahl der Prothese ist immer eine individuelle Entscheidung basierend auf der Einnahme lebenslanger oraler Antikoagulation (mechanisch) versus Degeneration der implantierten Klappe (biologisch). Im Alter 65–70 Jahre sind beide Prothesen möglich. Die Entscheidung basiert auf dem Wunsch des aufgeklärten Patienten (I C).
Perkutane Behandlungsmöglichkeiten
Katheterbasierte «MitraClip» bei Hochrisiko-Patienten (Herzteam-Diskussion) mit schwerer, funktioneller oder degenerativer MI. Nicht anwendbar bei Endokarditis, rheumatisch veränderten oder stark verkalkten Klappen. Mittels Implantation eines «Cardiobands» ist eine perkutane Ringannuloplastie bei vorwiegend funktioneller Mitralinsuffizienz möglich. Im Rahmen von Studien Implantation von speziellen Katheterklappen (aktuell sehr restriktive Einschlusskriterien).
Die 1 und jetzt auch 3 Jahresdaten der COAPT Studie zeigen klar eine Überlegenheit der perkutanen «Edge to Edge» Reparatur mit optimaler medikamentöser Therapie (OMT) der Herzinsuffizienz gegenüber der alleinigen OMT. Voraussetzung sind offenbar schwere Mitralinsuffizienzen, die nicht zu spät therapiert werden (EF 20-50%, LVESD < 70 mm, PASP ≤ 70 mmHg).
Management der schweren Mitralklappeninsuffizienz
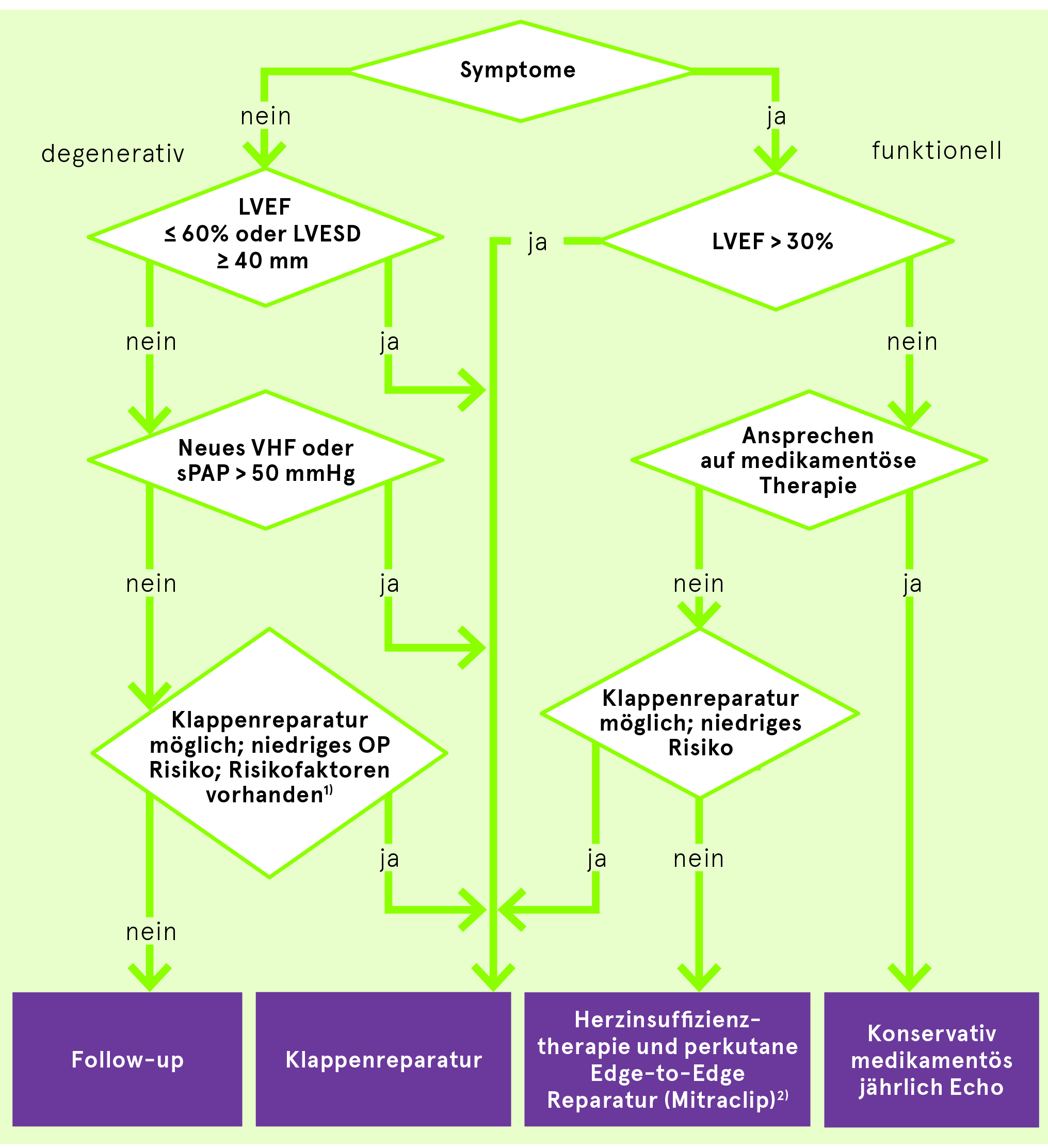
1) Asymptomatischer Patient, hohe Reparaturwahrscheinlichkeit > 95%, niedriges Risiko < 1%, EF > 60%, LVESD 40–44 mm soll eine Reparatur im Center of Excellence diskutiert werden (IIa C) bei: Patienten mit flail leaflet oderLA-Volumen ≥ 60 ml/m² BSA und Sinusrhythmus.
2) Erweiterte Herzinsuffizienztherapie beinhaltet kardiale Resynchronisationstherapie (CRT), Mitraclip, ventrikuläre Assist Devices, Herztransplantation.
Nach: Richtlinien Management von Herklappenerkrankungen ESC 2017 und ACC/AHA 2020
Mitralklappenstenose (MS)
Insgesamt selten: degenerativ (Einschränkung der Segelbeweglichkeit über eine Annulusverkalkung). Auch kongenitale Formen.
Prognose/Verlauf
Der Krankheitsverlauf ist schleichend. Im Mittel vergehen 16 Jahre zwischen dem rheumatischen Fieber und dem Vorliegen einer relevanten Mitralstenose.
Diagnostik
- Anamnese: eingeschränkte Leistungsfähigkeit, Dyspnoe (NYHA I-IV), Müdigkeit. Hämoptysen, Palpitationen, systemische Embolien bei Vorhofflimmern.
- Klinische Befunde/Auskultation in Linksseitenlage: «paukender» 1. Herzton, gefolgt von normalem 2. Herzton. Niederfrequentes Decrescendo-Geräusch in der Diastole. Punktum maximum über Herzsspitze. Bei Sinusrhythmus präsystolischer Klick.
Apparative Untersuchungen
- EKG: p-Mitrale, Vorhofflimmern?
- Transthorakale Echokardiografie (TTE): Beurteilung des Schweregrades, Verkalkung, andere morphologische Veränderungen zur Klassifizierung nach Wilkins vor evt. Ballonvalvuloplastie, Planimetrie der Öffnungsfläche im 3D-Datensatz
- Transösophageale Echokardiografie (TEE): Präoperativ/präinterventionell zur genauen morphologischen Beurteilung der Klappe und des subvalvulären Apparates, Nachweis/Ausschluss linksatrialer Thromben, 3D-Darstellung: zur multiplanaren Quantifizierung der Klappenöffnungsfläche (< 1.5 cm2)
- Stress-Echokardiografie (Dobutamin, idealerweise auch physikalisch): bei leichter/mittelschwerer Mitralstenose und ungeklärter Dyspnoe
- Koronarangiografie/ Rechtsherzkatheteruntersuchung: präoperativ/präinterventionell zum Ausschluss/Nachweis einer KHK, simultane Messung PCWP/LV-Druck zur Gradientenbestimmung
Therapie
Allgemeines: OAK mit VKA z.B. Phenprocoumon (Marcoumar; INR-Ziel 2-3) bei allen Patienten mit Vorhofflimmern oder nach arterieller Embolie (kein NOAK!). Bereits bei mittelschwerer Mitralstenose ist eine OAK zur Verhinderung thromboembolischer Ereignisse auch bei Sinusrhythmus angezeigt bei Vorliegen eines schwer vergrösserten linken Vorhofs (> 60 ml/m² oder > 50 mm Mode Diameter).
Patienten mit relevanter (d.h. mittelschwerer bis schwerer) Mitralstenose benötigen für eine ausreichende Ventrikelfüllung eine lange Diastole – daher muss (v.a. bei Vorhofflimmern) auf eine gute Frequenzkontrolle geachtet werden.
Katheterbasierte oder chirurgische Intervention bei symptomatischen Patienten mit schwerer (< 1.5 cm²) – sehr schwerer (< 1.0 cm²) Mitralstenose:
A) Perkutane Mitralklappenkommissurotomie (PMC):
Klasse I A-Empfehlung bei geeigneter Anatomie – bei Kontraindikation oder hohem OP-Risiko auch bei anderen Patienten (I C).
Die PMC erfolgt mithilfe eines Ballonkatheters bei geeigneten Patienten (Echo-Score nach Wilkins). Gutes Primärergebnis in > 80% der Patienten, ereignisfreies Überleben beträgt 30–70% in 10–20 Jahren.
Entscheidung über PMC nach klinischen Daten und Echo-Score. Beste Resultate bei jungen Patienten mit niedrigen Score-Werten, Sinusrhythmus, minimalen Verkalkungen und ohne begleitende Mitralklappeninsuffizienz. Kontraindikationen sind linksatrialer Thrombus, kommissurale schwere Verkalkungen, keine kommissurale Fusion und > leichte Mitralinsuffizienz.
B) Chirurgische Therapie
Meist Mitralklappenersatz (MKE) aufgrund der Klappendestruktion. In sehr spezifischen Fällen kann die Klappe rekonstruiert werden.
Trikuspidalinsuffizienz (TI)
Ätiologie und Pathophysiologie
Die Trikuspidalinsuffizienz (TI) ist die häufigste Manifestation der Trikuspidalklappenerkrankung und kann bis zu 65-85% der Bevölkerung weltweit betreffen.
Primäre (organische) Klappenläsionen ist selten (kongenital: Ebstein-Anomalie, Trikuspidalklappe mit doppelter Orifice, Trikuspidalklappendysplasie, Hypoplasie oder Cleft; Trauma: Brustwandtrauma, Endomyokardbiopsie; andere: Karzinoid-Syndrom, Endomyokardfibrose oder Endokarditis). Ein zunehmendes Problem sind Schrittmacher oder ICD Elektroden mit Perforationen, Verwachsungen und Verziehungen der Trikuspidalklappensegel und sekundärer TI.
Am häufigsten ist die funktionelle Trikuspidalklappeninsuffizienz (fTI) bei > 90% der Patienten.
Als Folge des negativen Remodellings eines überlasteten rechten Ventrikels (RV) kommt es zur Annulusdilatation und sekundär zur fehlenden Koaptation der Trikuspidalklappensegel. Hauptursachen sind eine relevante linksseitige Herzerkrankung oder eine pulmonale Hypertonie. Kann aber auch bei lang anhaltendem Vorhofflimmern und rechter Vorhofvergrösserung mit folgendem Remodelling des Trikuspidalannulus (und eben nicht des RV) beobachtet werden.
Klinische Evaluation und Laborbewertung
Die Klinik ist meist unspezifisch und bei der fTI meist auf die linksseitige Herzerkrankung zurückzuführen. Rechtsseitige Symptome treten meist erst im Spätstadium (D) auf mit verminderter Herzleistung (Kurzatmigkeit, Müdigkeit) und venösen Stauung (Hepatosplenomegalie, Darmstauung, Ödem und Aszites).
Laborchemisch zeigen sich Leberwerterhöhungen und eine Einschränkung der Nierenfunktion. Auch bei isolierter schwerer TI ist das BNP (≥ 200 pg/ml) ein negativer prognostischer Parameter.
Klinische und diagnostische Stadieneinteilung
| Stadium | Definition | Hämodynamik | Folgen | Klinisches Bild |
| B | Zunehmende TI | Zentraler Jet < 50% RA, Vena contracta< 7 mm, ERO < 0,4 cm², Regurgitations-volumen < 45 ml | keine | asymptomatisch |
| C | Asymptomatische schwere TI | Zentraler Jet ≥ 50% RA, vena contracta ≥ 7 mm, ERO ≥ 0.4 cm², Regurgitationsvolumen ≥ 45 ml, dichtes, dreiecksförmiges cw-Doppler Signal, Systolischer Rückfluss Lebervene | Dilatierter rechter Ventrikel und rechter Vorhof Erhöhter RA Druck mit «c-V» Welle |
Erhöhter zentralvenöser Druck asymptomatisch |
| D | Symptomatische schwere TI | siehe C | siehe C | Erhöhter zentral-venöser Druck, Belastungsdyspnoe, Erschöpfung, Aszites, Ödem |
Apparative Diagnostik
- Echokardiografie: linksseitige Herzfehler und LV Funktion, RV Funktion (Dimensionen, Funktion: TAPSE, FAC, S-TDI lateral und longitudinaler strain im 2D der Lateralwand), Trikuspidalannulus und Klappeninsuffizienz (s. Tabelle), 3D RV Volumina sowie RV-Funktion nach Möglichkeit
- Transösophageales Echografie: (ggf. ergänzend) Schrittmachersonden, Klappenmorphologie, im 3D direkte Darstellung der fehlenden Koaptation in multiplanarer Bildgebung, Farb 3D für area contracta der TI
- Herzkatheter Untersuchung/Koronarangiografie: exakte Bestimmung der rechtsseitigen Drücke, Herzminutenvolumen, KHK beim älteren Patienten, Risikostratifizierung
- CT: V.a. vor chirurgischer oder interventioneller Reparatur zum Ausschluss relevanter Verkalkungen, exakte Anatomie, Ausschluss KHK beim jungen Patienten
- MRI: Rechtsventrikuläre Volumina und Funktion
Medikamentöse Therapie
Frühzeitige Diskussion des Patienten im Herzteam zusammen mit klinischen Kardiologen, Herzinsuffizienzspezialisten, Chirurgen und strukturellen/interventionellen Kardiologen.
Therapie der Grunderkrankung bei fTI. Einsatz von Diuretika zur Milderung der Symptome bei schwerer TI (IIa C); in Kombination mit Mineralokortikoid-Rezeptorantagonisten, um die bei Patienten mit Leberstauung beobachtete Aktivierung des Renin-Angiotensin-Aldosteron-Systems abzuschwächen. Diskussion pharmakologischer Therapien zur Senkung des pulmonalen Gefässwiderstands (IIb C).
Chirurgische und Interventionelle Therapie
Chirurgische Klappenreparatur/Klappenersatz ist die optimale Korrekturmethode bei schwerer symptomatischer Trikuspidalinsuffizienz.
Allerdings: viele Patienten werden zu spät vorgestellt und sind dann inoperabel oder haben ein hohes chirurgisches Risiko aufgrund von Begleitpathologien, schwerer RV-Dysfunktion, oft als Folge eines lang anhaltenden unbehandelten Zustands. Die wissenschaftliche Evidenz ist insgesamt mässig.
Parallel erfolgt in den letzten Jahren Entwicklung von Trans-Katheter-Trikuspidalklappeninterventionen (TTVI). Bislang liegen gute Daten für die Durchführbarkeit und Sicherheit vor; Langzeitergebnisse sind ausstehend.
Wichtig: alle Patienten frühzeitig in den Herzteams diskutieren um rechtzeitige Therapien zu ermöglichen.
Management der schweren Trikuspidalklappeninsuffizienz
| Fachgesellschaft/Evidenz | Empfehlungen zum Interventionszeitpunkt | |||
| AHA/ACC 2020 | ESC/EACTS 2017 | |||
| COR | LOE | COR | LOE | |
| 1 | B-NR | I | C | Schwere TI, Notwendigkeit für linksseitige (Klappen-)Operation: chirurgische Korrektur der TI empfohlen |
| 2a | B-NR | IIa | C | Trikuspidalklappenchirurgie kann sinnvoll sein bei progressiver TI (Stadium B) wenn entweder (1) enddiastolische Trikuspidalklappenanulusdilatation > 40 mm oder (2) Zeichen oder Symptome der Rechtsherzinsuffizienz. |
| 2a | B-NR | I | C | Zeichen oder Symptome der Rechtsherzinsuffizienz und schwere primäre TI (Stadium D): isolierte OP der Trikuspidalklappe kann hilfreich sein um Symptome und Hospitalisationen zu verringern. |
| 2a | B-NR | Zeichen oder Symptome der Rechtsherzinsuffizienz und schwere, isolierte sekundäre TI bei Anulusdilatation (ohne pulmonale Hypertonie oder linksseitige Herzkrankheit), die unzureichend auf medikamentöse Therapie ansprechen (Stadium D): isolierte OP der Trikuspidalklappe kann hilfreich sein um Symptome und Hospitalisationen zu verringern. | ||
| 2b | C-LD | IIa | C | Asymptomatisch mit schwerer primärer TI (Stadium C) und progressiver RV Dilatation oder systolischer RV Dysfunktion: Isolierte Trikuspidalklappenchirurgie kann erwogen werden. |
| 2b | B | IIa | C | Zeichen und Symptomen der Rechtsherzinsuffizienz und schwerer TI (Stadium D) und vorgängiger linksseitiger Herzklappenoperation: Isolierte Trikuspidalklappenchirurgie kann erwogen werden, wenn keine schwere pulmonale Hypertonie oder schwere Rechtsherzinsuffizienz vorliegt. |
Klappenerkrankungen und perioperatives Management bei «nicht-kardialen Operationen»
Nicht-kardiale Eingriffe sind mit vertretbarem Risiko möglich bei Patienten mit relevanter AI und MI (auch schwer), wenn die linksventrikuläre Funktion normal ist. Das gleich gilt bei asymptomatischen Patienten mit MS ohne relevante pulmonale Hypertonie (sPAP < 50 mmHg). AS: Bei Patienten mit symptomatischer AS und niedrigem Operations-Risiko für den Klappenersatz primär Klappenoperation/-eingriff. Bei asymptomatischen Patienten gilt für nicht-kardiale Operation mit niedrigem oder intermediärem Risiko primär Operation unter gutem Monitoring. Bei hohem Operations-Risiko und bei gleichzeitig niedrigem Risiko für die Klappenoperation sollte primär der Klappenersatz durchgeführt werden: Diskussion im Herzteam.
Follow-up bei Klappenerkrankungen postoperativ/postinterventionell
- Endokarditisprophylaxe siehe entsprechendes Kapitel bei allen implantierten Fremdmaterialien (auch Ringe und Neochords), TAVI, Mitraclip, Cardioband
- Regelmässige Zahnreinigungen und Kontrollen
- 3 Monate postoperativ Standortbestimmung mit Röntgen-Thorax, Labor, Echokardiografie
- Anschliessend zeitlebens jährliche klinische Verlaufskontrollen mit Labor und Echokardiografie (v.a. bei biolog. Prothesen: Degeneration? Gradienten? Paravalvuläre Leckage? Zusatzstrukturen?)
- Biologische Klappen mit Gradientenanstieg: Thrombose? Therapie mit Vitamin K-Antagonist (VKA) z.B. Phenprocoumon (Marcoumar) mit Ziel-INR 2–3, kein NOAK
- Mechanische Klappen: Hämolyse? INR-Werte? Bei schwieriger Beurteilung/Gradientenzunahme im Echo ggf. TEE und Klappendurchleuchtung
- Mechanische Klappen
- VKA-Therapie z.B. Phenprocoumon (Marcoumar): INR-Zielwerte nach Massgabe des Chirurgen/Klappentyp/Risikofaktoren (üblicherweise moderner AKE 2.5 (+ Risikofaktor 3.0); MKE/TKE 3.0 (kein NOAK!)
- Zusätzlich ASS 100 mg/Tag bei thrombembolischen Ereignissen trotz INR im Zielbereich (IIa C)
- INR-Selbstmonitoring bei mechanischen Klappen und geeigneten Patienten empfohlen (I B)
- Biologische Klappen
- Nach biologischem Mitral-/Tricuspidalklappenersatz: VKA z.B. Phenprocoumon (Marcoumar) mit Ziel-INR 2.5 für 3 Monate (IIa C) bei niedrigem Blutungsrisiko
- Nach biologischem Aortenklappenersatz: Aspirin 100 mg/Tag für 3 Monate möglich (IIa C)
- Nach TAVI: VKA z.B. Phenprocoumon (Marcoumar) mit Ziel-INR 2.5 für > 3 Monate (IIb B) oder ASS 100 mg/Tag + Clopidogrel 75 mg/Tag für 6 Monate, anschliessend Monotherapie mit einfachem Thrombozytenaggregationshemmer unbefristet (IIa C)
- TAVI und hohes Blutungsrisiko: bereits initial Monotherapie mit Thrombozytenaggregationshemmer (IIb C)
Quelle/Link
- Baumgartner H, Falk V, Bax JJ et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739–2791 https://doi.org/10.1093/eurheartj/ehx391
- Otto CM, Nishimura RA, Bonow RO. 2020 ACC/AHA guideline for the management of patients with valvular heart disease. Circulation. 2021;143:e72–e227. https://doi.org/10.1161/CIR.0000000000000923
Dr. Philipp K. Haager
Dr. Niklas Ehl
Dr. Lucas Jörg
PD Dr. Maurizio Taramasso