Vorhofflimmern
Autorenteam Kantonsspital St.Gallen
Definition
Unkoordinierte Vorhofserregung mit einer Vorhoffrequenz von 300–600/min. Das Oberflächen-EKG zeigt eine absolute Arrhythmie und keine eindeutigen P-Wellen mit Andauern >30 Sekunden. P-Wellen bzw. eine scheinbar organisierte Vorhofsaktivität kann bei fibrotisch veränderten Vorhöfen oder unter antiarrhythmischer Therapie (Amiodaron) erkennbar sein. Diese weisen dann eine andere Morphologie als z.B. bei typischem Vorhofflattern auf.
Epidemiologie
Die Prävalenz von Vorhofflimmern (VHF) liegt bei 1–2% der Gesamtbevölkerung und ist wesentlich altersabhängig (0.5% bei 40- bis 50-Jährigen, 5–15% bei über 80-Jährigen).
Ursachen
- Akut (meist reversibel): Hyperthyreose, Alkohol, Drogen (Kokain), akute Lungenembolie, Katecholamin getriggert (nach Operationen, bei Infekten), Myokardinfarkt
- Chronisch (häufig irreversibel): langjährige arterielle Hypertonie oder Diabetes, Klappenvitien
- Genetisch
Klassifizierung
- Erstdiagnostiziert: Erstmanifestation eines VHF
- Paroxysmal: selbstlimitierend oder Kardioversion < 7 Tage
- Persistierend: anhaltend > 7 Tage
- Lang anhaltend persistierend: anhaltend > 1 Jahr
- Permanent: keine eigentliche zeitliche Einteilung, sondern entspricht Behandlungsstrategie: VHF wird akzeptiert, keine (weiteren) Versuche einer Rhythmuskontrolle
- Valvulär: mittelschwere oder schwere Mitralklappenstenose (siehe Seite), mechanische Klappenprothese (siehe Seite)
- Therapie mit Vitamin K-Antagonist; NOAK kontraindiziert
Symptom Klassifikation
- EHRA 1: keine Symptome
- EHRA 2a: milde Symptome (Alltagsaktivität nicht beeinträchtigt)
- EHRA 2b: moderate Symptome (Alltagsaktivität nicht beeinträchtigt, jedoch Patient durch Symptome gestört)
- EHRA 3: schwere Symptome (Alltagsaktivität beeinträchtigt)
- EHRA 4: schwerste Symptome (Alltagsaktivität verunmöglicht)
Grundlegende Abklärungen
- Dokumentation Vorhofflimmern mit Ruhe-EKG
- Klinische Untersuchung: kardial kompensiert? Hämodynamisch stabil?
- Labor: Blutbild, Gerinnung, Leber-/Nierenfunktion, Elektrolyte, TSH
- TTE: strukturelle Herzerkrankung, Kontraindikation NOAK (Mitralstenose)? Volumen linker Vorhof?
- Evtl. Holter-EKG: Frequenzkontrolle? Pausen/Bradykardien?
- Begleitfaktoren: Aktivität, Alkoholkonsum, Adipositas, Einstellung arterielle Hypertonie, OSAS, Diabetes mellitus
Die wichtigsten Fragen
- Klassifikation: Paroxysmal oder persistierend? Beschwerden?
- Therapiestrategie: Frequenz- oder Rhythmuskontrolle?
- Andauern des VHF? Wenn sicher (möglichst dokumentiert) <48h: Elektrische oder medikamentöse Kardioversion nach umgehendem Beginn einer Antikoagulation ohne weitere Abklärung möglich. > 48 Std oder unbekannt: Vor Kardioversion TEE/CT (intrakardiale Thromben?) oder therapeutische Antikoagulation über 3 Wochen zwingend.
- Thromboembolieprophylaxe indiziert? Siehe «Indikation zur oralen Antikoagulation» Seite
Vorgehen bei Vorhofflimmern auf Notfallstation
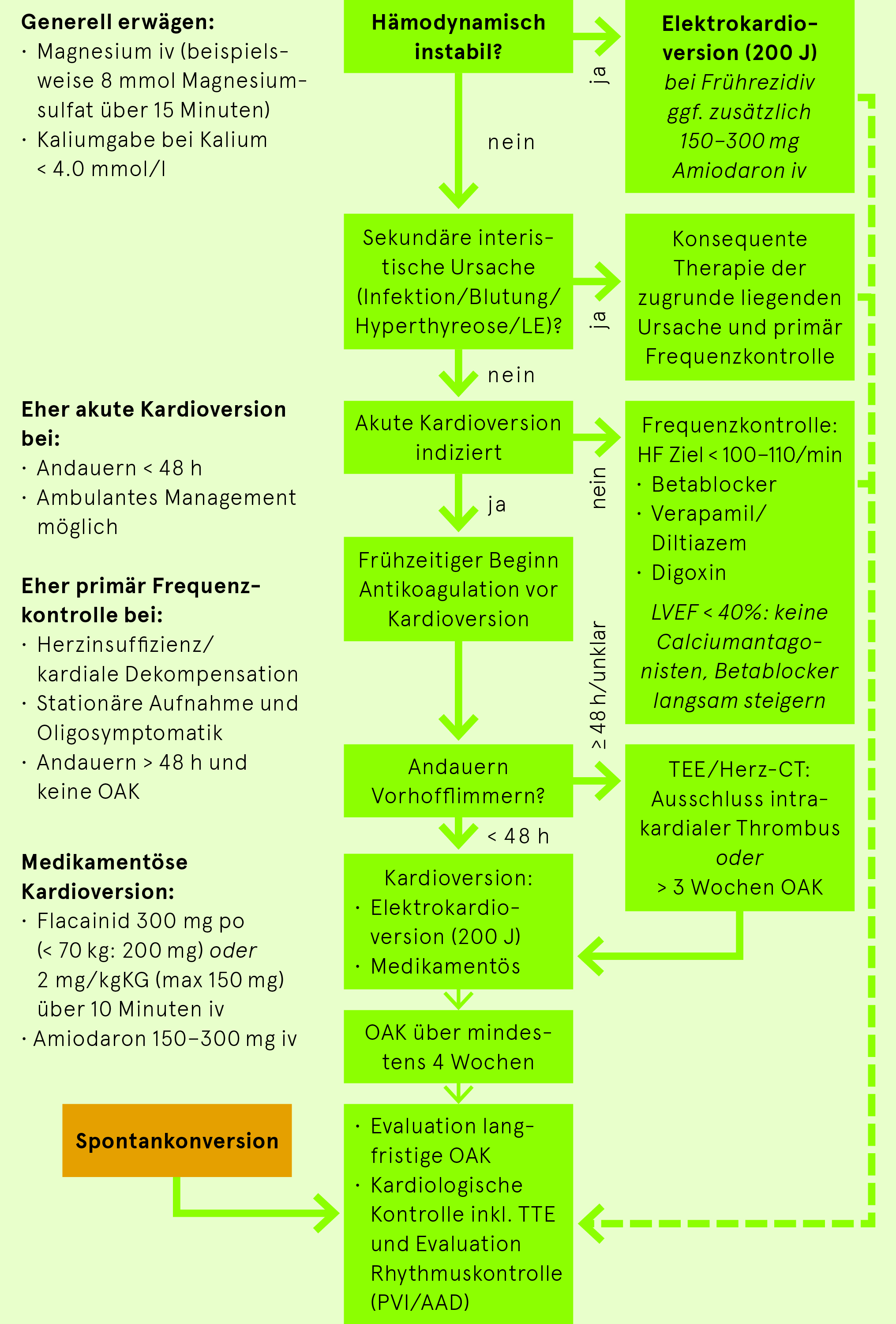
Frequenz- oder Rhythmuskontrolle
Alle grossen klinischen Studien zeigen bisher keinen klaren Überlebensvorteil einer Rhythmuskontrolle gegenüber einer Frequenzkontrolle, was durch aktuelle Studien aber zunehmend infrage gestellt wird. Es scheint jedoch, dass die frühe Rhythmisierung von Patienten mit neu aufgetretenem Vorhofflimmern in Bezug auf die weitere kardiovaskuläre Morbidität Vorteile bringt. Zudem sind jüngere, symptomatische Patienten in allen Studien unterrepräsentiert. Eine Rhythmuskontrolle ist für jüngere oder symptomatische Patienten und für Patienten mit neu aufgetretenem Vorhofflimmern sinnvoll. Bei diffusem Beschwerdebild/Unklarheit, ob Vorhofflimmern für die Symptome verantwortlich ist → «Vorhofflimmern-Ferien» siehe nächster Abschnitt.
Klinische Probleme
- Symptomkorrelation: Bei paroxysmalem VHF werden häufig Palpitationen bemerkt. Bei persistierendem VHF eher unspezifische Symptome (Leistungsintoleranz, Müdigkeit). Patienten mit persistierendem VHF haben jedoch auch häufiger extrakardiale (Hypertonie, OSAS) und kardiale Erkrankungen (KHK, hypertensive Herzkrankheit usw.), sodass die klinische Relevanz von insbesondere normokardem VHF unklar ist. In dieser Situation empfehlen sich «Vorhofflimmer-Ferien»: Elektrokonversion, ggf. vorgängig Amiodaron-Therapie (Reduktion Rezidivwahrscheinlichkeit) und Reevaluation der Symptome im Sinusrhythmus (evtl. Ergometrie vor/nach EKV).
- Tachykardes VHF: kann zu einer linksventrikulären Dysfunktion führen.
- Tachykardes VHF mit hypertensiven BD-Werten: im Alter schlecht toleriert; oft Ursache einer akuten Herzinsuffizienz (auch ohne relevante strukt. Herzerkrankung; diastolische Dysfunktion!)
- Bradykardes VHF: oft von Schwindel und Synkopen begleitet; Cave: Sonderform des Sick-Sinus-Syndroms: «Brady-Tachy-Syndrom» bei medikamentöser Therapie des vermeintlich nur tachykarden VHF (Betablocker-Augentropfen wirken auch systemisch!)
- Postoperativ erstmalig aufgetretenes VHF: Nach Herzchirurgie ist die Wertigkeit einer langfristigen Thromboembolieprophylaxe und/oder antiarrhythmischen Therapie unklar. Bei VHF nach nicht-herzchirurgischer Operation und bei als «sekundär» beurteiltem Vorhofflimmern (Fieber, Infekt, akuter Myokardinfarkt, etc.) richtet sich die Indikation zur Thromboembolieprophylaxe aber einzig nach dem CHA2DS2-VASc Score und sollte nicht generell vorenthalten werden.
- Asymptomatisches VHF: relativ häufig von TIA und ischämischem Hirnschlag begleitet. Cave: nach Pulmonalvenenisolation (PVI) möglich (auch bei vormals symptomatischen Patienten) → Thromboembolieprophylaxe nach PVI in Abhängigkeit des CHA2DS2-VASc Scores weiterführen.
Indikation zur oralen Antikoagulation (OAK)
Nach einer Kardioversion ist eine Thromboembolieprophylaxe mit vorzugsweise NOAK oder sekundär VKA immer für 4 Wochen (eingeschränkte Vorhofskontraktion: «Stunning») und nach einer Pulmonalvenenisolation (Endothelläsionen im linken Vorhof) für 3 Monate indiziert. Die Indikation für eine langfristige Thromboembolieprophylaxe mit vorzugsweise NOAK oder sekundär VKA richtet sich nach dem CHA2DS2-VASc Score. Aspirin hat in dieser Indikation keinen Stellenwert mehr.
CHA2DS2-VASc Score (max. 9 Punkte, Alter gibt 0, 1 oder 2 Punkte)
| Risikofaktor | Score |
| Herzinsuffizienz/LV-Dysfunktion
Art. Hypertonie Alter ≥ 75 Jahre Diabetes mellitus Stroke/TIA/andere Thromboembolie Gefässerkrankung (KHK, PAVK) Alter 65–74 Jahre Weibliches Geschlecht |
1
1 2 1 2 1 1 1 |
| Maximaler Score | 9 |
Indikation zur oralen Antikoagulation gemäss CHA2DS2-VASc Score
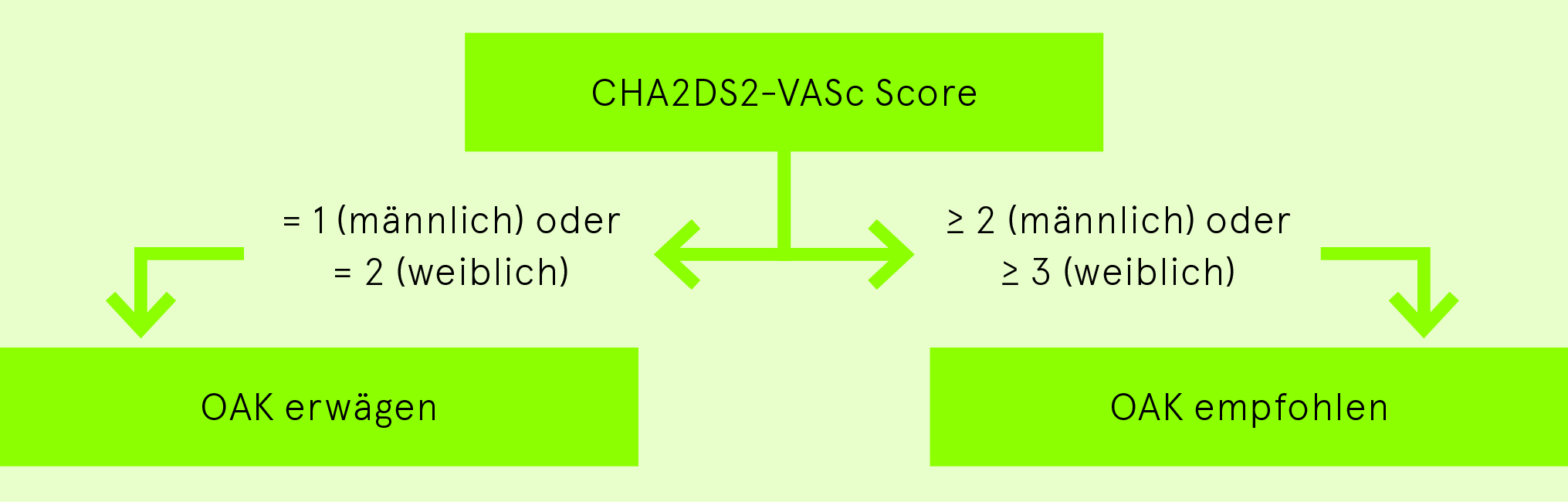
Bei bestehender Kontraindikation für eine orale Antikoagulation ist eine Evaluation eines interventionellen Vorhofsohrverschlusses sinnvoll.
Neue orale Antikoagulantien (NOAK)
Effizienz/Sicherheit, Indikation
- Mindestens gleich gute Effizienz im Vergleich zu Vitamin K-Antagonisten (VKA) d.h. Phenprocoumon (Marcoumar) bzw. Acenocoumarol (Sintrom)
- Verbesserte Sicherheit: weniger Hirnblutungen, weniger schwere und lebensbedrohliche Blutungen (im Vergleich mit VKA)
- Gleichwertige Indikation (Klasse I) zur Thromboembolieprophylaxe bei VHF-Patienten wie VKA; grundsätzlich wird den NOAKs unter Beachtung der Kontraindikationen (schwere Niereninsuffienz, mechanische Herzklappe, mittel- oder hochgradige Mitralstenose) der Vorzug gegeben
Zu beachten gilt
- Compliance kann die Wirksamkeit von NOAKs erheblich beeinträchtigen (kurze Halbwertszeit, kein Monitorring); aber Compliance auch bei Vitamin K-Antagonisten (VKA) nicht optimal
- Kombination mit Thrombozytenaggregationshemmern bei Patienten mit Vorhofflimmern nach ACS und/oder Stenting: Siehe Kapitel «ACS», Grafik Seite
- Risiko für gastrointestinale Blutungen etwas erhöht bei Rivaroxaban 20 mg und Dabigatran 150 mg 2x/Tag
- Mittelschwere Niereninsuffizienz: regelmässige Kreatininkontrolle nötig (Dabigatran höchste Kummulationsgefahr da 80% renal eleminiert). Die Dosis gemäss Zulassung richtet sich nach der Kreatininclearence und nicht nach der eGFR.
- Schwere Niereninsuffizienz: kaum Daten (weder für NOAK noch für VKA); Apixaban und Edoxaban whs. die besten Optionen
- Quantifizierung der antikoagulatorischen Effektes (Anti-Faktor-Xa Aktivität) im Notfall (Blutung, Operation) möglich, aber nicht generell zur Therapiekontrolle
- Nach bariatrischer Chirurgie wenig Daten hinsichtlich Resorption von NOAK. Primär Verwendung von VKA oder von Apixaban unter Kontrolle der Anti-Faktor-Xa Aktivität
- Therapieoption im Falle einer Blutung siehe «Hämostasiologische Massnahmen» Seite
- Umstellung VKA auf NOAK: Beginn NOAK sobald INR ≤ 2
Blutungsrisiko: HAS-BLED Score (untersucht für Blutungsrisiko unter Warfarin)
HAS-BLED Score ≥ 3 = Blutungsrisiko erhöht. Patienten sollten, wenn indiziert, dennoch antikoaguliert werden. Im Vordergrund steht eine optimale Kontrolle der modifizierbaren Blutungsrisikofaktoren (unkontrollierte arterielle Hypertonie, unter VKA optimales INR Monitoring oder Wechsel auf NOAK, Verzicht auf NSAR, Reduktion Alkoholkonsum).
| Buchstabe | Klinisches Charakteristikum | Punkte |
| H | Art. Hypertonie | 1 |
| A | Abnorme Nieren*- und Leberfunktion** (je ein Punkt) | 1 oder 2 |
| S | Schlaganfall | 1 |
| B | Blutung | 1 |
| L | Labiler INR | 1 |
| E | Alter > 65 Jahre | 1 |
| D | Drogen und/oder Alkohol ( je ein Punkt) | 1 oder 2 |
| Max. 9 Punkte |
Vorgehen bei Indikation für Thrombozytenaggregationshemmung und oraler Antikoagulation
Bei stabiler KHK (keine Angina pectoris, keine akute Ischämie und/oder Stentimplantation < 12 Monate): OAK (NOAK, VKA) Monotherapie (siehe auch Kapitel Chronisches Koronarsyndrom Seite). Nach einem ACS/PTCA gemäss Leitlinien ACS (siehe Grafik Seite).
Medikamente zur Frequenzkontrolle
Betablocker
- po: z.B. Bisoprolol (Concor) 5–10 mg
- iv: z.B. Metoprolol (Beloc) langsam 1-mg-weise iv, Zieldosis 5 mg iv, dann auf po wechseln; in der Akutsituation Bolus 5 mg langsam iv, repetierbar alle 10 Min. bis max. 15 mg, KI: eingeschränkte LVEF
Ca-Antagonisten
(Wenn möglich immer po, da iv negativ inotrop) Cave: schlechte LVEF
- po: Diltiazem (Dilzem) po 3× 60 mg/Tag, später bis 2× 120 mg/Tag
- iv: falls nötig Diltiazem 0.25 mg/kg Bolus iv, evtl. wiederholen, Dauerinfusion 5–15 mg/Std. (Cave: Herzinsuffizienz)
- Isoptin immer po geben, max. Dosis 480 mg/Tag
Digoxin (bei Herzinsuffizienz)
- (0.25-) 0.5 mg Bolus iv, evtl. wiederholen, maximal 1 mg (in 3 Dosen), dann po weiter (Cave: Hypokaliämie, Niereninsuffizienz)
Kardioversion
Eletrische Kardioversion (EKV)
- Schnellste und effektivste Konversion des VHF
- Indiziert bei symptomatischen Patienten mit Arrhythmiebeginn < 48 Std. oder suffizienter Antikoagulation ≥ 3 Wochen/TEE oder hämodynamischer Instabilität
- EKV (synchronisiert!) in Kurznarkose/Analgosedation mit 200 J (biphasisch)
Medikamentöse Kardioversion
- Primär oder wenn mit EKV kein Erfolg
- Alle unten angeführten Antiarrhythmika können bei nicht erfolgreicher EKV angewendet werden. EKV nach aufdosierter Medikamentengabe wiederholen
| Medikamente (Klasse) | Dosis | Erfolg | Kontraindikationen/Warnhinweise |
| Amiodaron (Cordarone) (III) |
|
ca. 70% |
|
| Flecainid (Tambocor) (Ic) |
|
ca. 80% |
|
| Vernakalant (Brinavess) |
|
|
Medikamente zur Rhythmuskontrolle
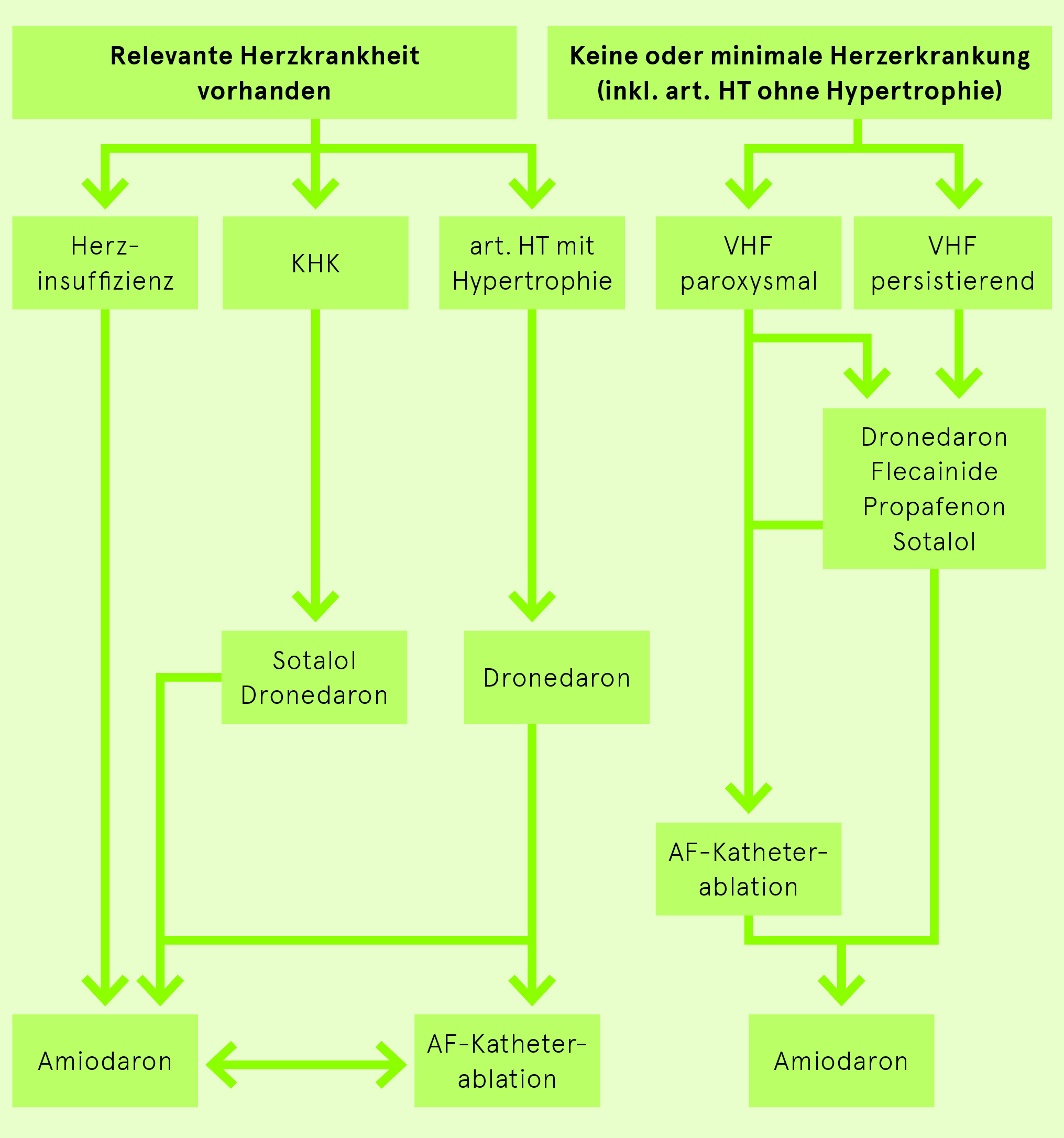
Keine strukturelle Herzerkrankung
- Betablocker
- Antiarrhythmika:
- Flecainid (Tambocor) 2× 50–150 mg po immer mit Betablocker kombinieren (Vorhofflimmern kann durch Flecainid in Vorhofflattern organisieren und 1:1 auf die Ventrikel übergeleitet werden, was hämodynamisch häufig schlecht vertragen wird bzw. Kammerflimmern induzieren kann).
- Dronedarone (Multaq) 2× 400 mg po. Komplexes Interaktionspotential (NOAK, Digoxin, Calciumantagonisten): Interaktionscheck. KI: kürzliche kardiale Dekompensation, NYHA III/IV, CrCl < 30ml/min, QTc>500ms
- Sotalol (Sotalex) 2× 80–160 mg po (Cave: Torsades-de-pointes bei Hypokaliämie und QTc-Verlängerung, Niereninsuffizienz)
Strukturelle Herzerkrankung
- Antiarrhythmika:
- Amiodaron (Cordarone). Regelmässige Kontrolle der Leber- und Schilddrüsenwerte, optimaler UV Schutz
- Sotalol (Sotalex) 2× 80–160 mg po (falls keine Herzinsuffizienz und keine Niereninsuffizienz vorhanden; Cave: erhöhtes Risiko von Torsades-de-pointes bei Hypokaliämie und QTc-Verlängerung)
- Dronedaron (Multaq) 2× 400 mg po. Komplexes Interaktionspotential (NOAK, Digoxin, Calciumantagonisten): Interaktionscheck. KI: kürzliche kardiale Dekompensation, NYHA III/IV, CrCl < 30ml/min, QTc > 500ms
Ablationsbehandlung bei Vorhofflimmern (mit Rhythmologen besprechen)
Pulmonalvenenisolation (PVI)
- Symptomatisches Vorhofflimmern oder Nebenwirkungen der Antiarrhythmika-Therapie, Tachykardie induzierte Kardiomyopathie, gewisse Patienten mit Herzinsuffizienz
- Grundsätzlich bessere Erfolgsrate bei paroxysmalem VHF und je weniger strukturelle Herzerkrankung vorhanden
- Langzeiterfolg etwa 70–80%; 20–30% der Patienten benötigen aber Zweit- oder Drittinterventionen; Komplikationsrate insgesamt 2–3%: Leistenkomplikationen (Hämatom, AV-Fistel, Pseudoaneurysma) 1–2%, Perikardtamponade 1-2%, Rest < 1%: TIA/Insult, Oesophagoatriale Fistel[1], Pulmonalvenenstenose[2]< 0.5%.
AV-Knoten-Ablation nach vorgängiger Schrittmacherimplantation
- Nach Implantation eines Schrittmachers wird der AV-Knoten abladiert. Geeignet für ältere Patienten mit Nebenwirkungen der Antiarrhythmika-Therapie oder mit Tachykardie-Bradykardie-Syndrom (frequenzsenkende Medikamente sollen tachykarde Episoden verhindern, führen aber zu Bradykardien und AV-Überleitungsstörungen)
- Vorteil: Effektive Frequenzkontrolle; Antiarrhythmika können abgesetzt werden
- Nachteil: Schrittmacherabhängigkeit, dyssynchrones Pacing im RV, deshalb bei EF < 40% vor Knoten-Ablation CRT-Implantation nötig
Hybridtherapie
- Darunter versteht man eine rechtsatriale Isthmusablation bei Vorhofflattern, wenn Vorhofflimmern unter medikamentöser Therapie zu einem Vorhofflattern organisiert
Erhaltung des Sinusrhythmus bei VHF
Quellen/Links
- Hindricks G et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation. EHJ. 2021 Feb 1;42(5):373-498.
- Stiell I et al. CAEP Acute Atrial Fibrillation/Flutter Best Practices Checklist. CJEM 2018;20(3):334-342.
Dr. Florian Franzeck, Prof. Dr. Peter Ammann,
Dr. David Altmann, Dr. Dr. Roman Brenner, Dr. Jörg Scheler
- Symptome Tage bis Wochen nach PVI: (bedingt durch Luftembolie, Mediastinitis) Fieber, Sepsis, Insult und Schluckbeschwerden. Hohe Letalität daher rasches Handeln: Computertomografie mit oralem und iv Kontrastmittel, KEINE Gastroskopie (Luftembolie!), Involvierung Rhythmologie, Chirurgie und Infektiologie:. Nüchtern lassen, hochdosiert PPI, antibiotische Breitbandtherapie. ↵
- Symptome oft Monate nach PVI: Dyspnoe, Husten, Hämoptysen, rez. Pulmonale Infekte. ↵
