Chronisches Koronarsyndrom – Diagnostik und Therapie
Einleitung/Definition
Die Koronare Herzkrankheit (KHK) ist definiert als Manifestation einer Arteriosklerose an den Herzkranzarterien. Abhängig vom Missverhältnis zwischen myokardialem Sauerstoffbedarf und -Angebot resultiert daraus eine kardiale Ischämie. Es gibt zwei Manifestationsformen der KHK. Alle Situationen ausserhalb des akuten Koronarsyndroms (ACS) werden als «Chronisches Koronarsyndrom CCS» bezeichent (ESC Leitlinien 2019). Der Begriff soll auf die potentiell dynamische Komponente der koronaren Herzkrankheit auch im chronischen Stadium hinweisen.
Symptome und klinische Befunde
Die pectoris ist nach ESC-Richtlinien definiert als die Summe der 3 Charakteristika:
- Retrosternaler Thoraxschmerz (druckartig, Enge) und Dauer (≤ 10 min), evtl. mit Ausstrahlung linker Arm/Schulter, Hals/Kiefer
- Hervorgerufen durch körperliche Anstrengung oder emotionale Belastung, verstärkt bei Kälte
- Besserung durch Ruhe und/oder Nitrate innerhalb von Minuten.
Gemäss den ESC-Leitlinien Chronisches Koronarsyndrom (CCS) 2019 wird die (Belastungs-)Dyspnoe als Angina-Äquivalent berücksichtigt. Nur ca. 10–15% präsentieren sich mit einer typischen, alle 3 der genannten Punkte umfassenden AP. V. a. bei älteren Patienten, häufiger auch bei Frauen und Diabetikern ist die Symptomatik oft atypisch (2 Punkte).
Diagnostik
Abklärungsstrategie
Bei symptomatischen Patienten mit vermuteter Koronarer Herzerkrankung erfolgt die Abklärung anhand der Vortestwahrscheinlichkeit und der klinischen Wahrscheinlichkeit.
Die Einschätzung der Vortestwahrscheinlichkeit für eine stenosierende KHK erfolgt anhand einfacher klinischer Charakteristika wie Art des Brustschmerzes, Alter und Geschlecht des Patienten und nimmt eine zentrale Rolle für das weitere diagnostische Vorgehen ein (siehe folgende Tabelle 1). Als modifizierende Faktoren der Vortestwahrscheinlichkeit werden dabei zusätzlich berücksichtigt: kardiovaskuläre Risikofaktoren (kv RF), EKG-Veränderungen, vaskuläre Erkrankung (PAVK, CVI/TIA), LV-Dysfunktion und Niereninsuffizienz (siehe Tabelle 2). Bei symptomatischen Patienten mit einer Vortestwahrscheinlichkeit von 5–15% besteht eine hohe klinische Wahrscheinlichkeit und eine weiter Abklärung ist empfohlen.
Vortestwahrscheinlichkeiten (VTW) für das Vorliegen einer obstruktiven Koronaren Herzerkrankung

Nicht-invasive Risikostratifizierung bei Koronarer Herzerkrankung (KHK)
| Hohes Risiko (> 3% jährliches Mortalitätsrisiko) |
|
| Intermediäres Risiko (1–3% jährliches Mortalitätsrisiko) |
|
| Niedriges Risiko (< 1% jährliches Mortalitätsrisiko) |
|


Vergleich der nicht-invasiven Untersuchungen: Diagnostische Genauigkeit, Limitationen, Vor- und Nachteile
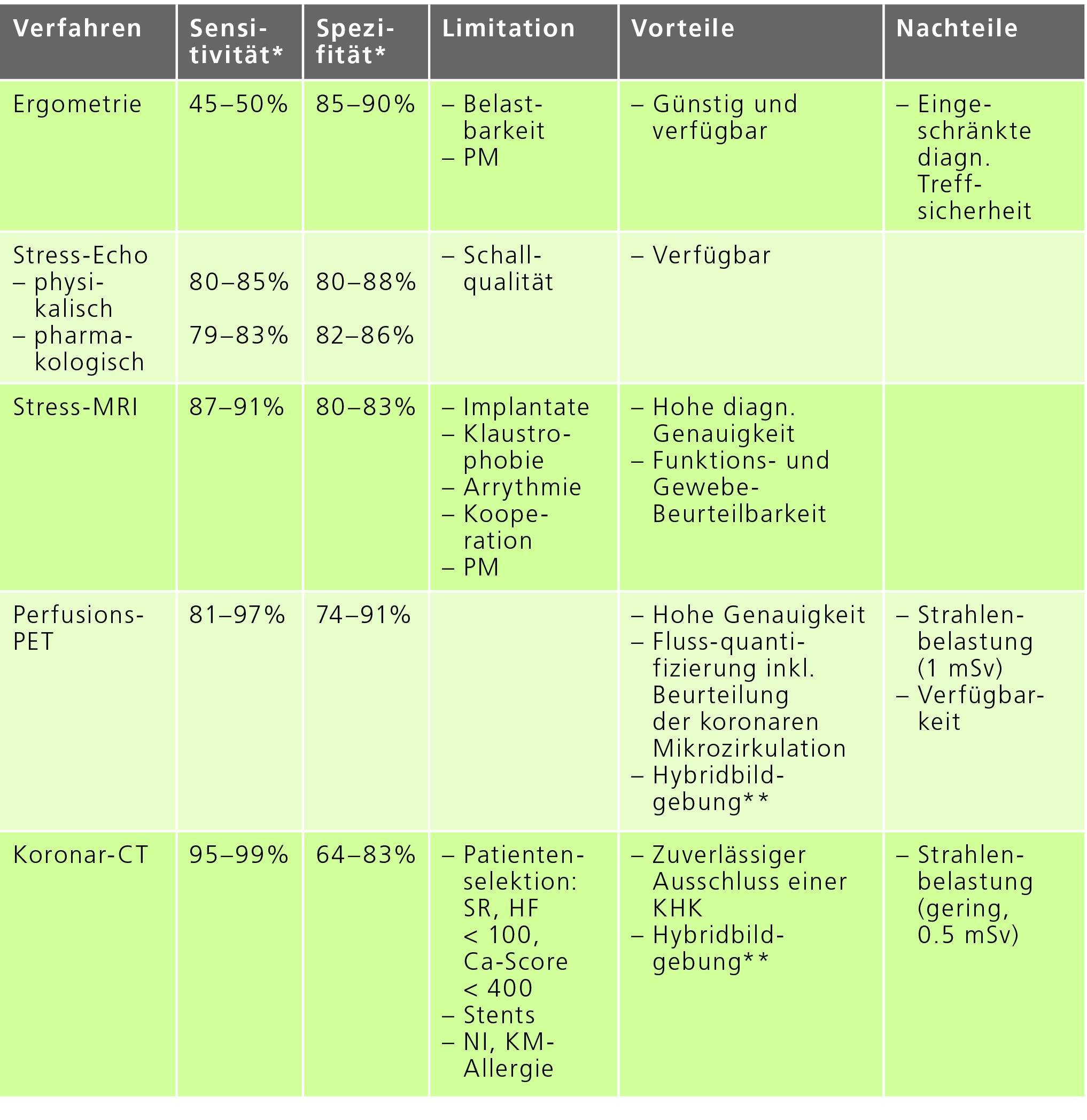
*im Vergleich mit dem Referenzstandard invasive Diagnostik;
**Hybridbildgebung: Dieses Verfahren ermöglicht die Kombination von anatomischer/morphologischer und funktioneller Bildgebung, z.B. als PET/CT Herz.
PM = Schrittmacher; NI = Niereninsuffizienz; KM = Kontrastmitttel
Fahrrad-Ergometrie
Möglichkeiten
- Möglicher Ischämienachweis, geringe Sensitivität (gute Ausbelastung: bei Doppelprodukt > 25’000 (HFmax × BDsystmax) / HF >85 % der berechneten HFmax )
- Objektivierung der körperlichen Leistungsfähigkeit (z.B. im Rahmen der präoperativen Abklärung)
Indikationen
- Bei Verdacht auf KHK: in den ESC Leitlinien CCS 2019 werden zur Primärdiagnostik nicht-invasive bildgebende Tests empfohlen
- Belastungs-EKG als möglicher initialer Ischämietest bei niedriger Vortest-Wahrscheinlichkeit (< 19%)
- Im Management von KHK-Patienten empfohlenzur Beurteilung von Leistungsfähigkeit, Symptomen, Arrhythmien, Blutdruckverhalten und Risikoabschätzung
- Bei bekannter KHK unter Therapie zur Beurteilung der Symptom- und Ischämiekontrolle möglich
Limiten respektive fehlende Aussagekraft
- Vorbestehende ST-Streckensenkung (1mm) in Ruhe
- WPW, Linksschenkelblock (LSB), Schrittmacher-Rhythmus
- Digoxin-Therapie
Stress-Echokardiografie
Technik
Echokardiografisch wird die Kontraktilität des linken Ventrikels in Ruhe und unter Belastung dargestellt. Nimmt die Kontraktilität unter der (ergometrischen oder pharmakologischen) Belastung lokal ab, entspricht dies einem indirekten Ischämienachweis und erlaubt Rückschlüsse auf die Lokalisation und Ausmass der Ischämie.
Indikationen
- Ischämiediagnostik
- Präoperative Risikostratifizierung
- Spezifische Fragestellungen bei Klappenvitien (z.B. kontraktive Reserve)
Limiten
- Ungenügende Echoqualität
- Relevante Herzrhythmusstörungen, unkontrollierte art. Hypertonie
Kardiale Magnetresonanztomografie mit Belastung (Stress-MRI)
Technik
Die kardiale Magnetresonanztomografie eignet sich besonders zur Darstellung von Struktur und Funktion des Herzens und erlaubt nach intravenöser Kontrastmittelapplikation sowohl die Beurteilung der Koronarperfusion (Ruhe/Belastung) als auch die Identifizierung und Quantifizierung von infarziertem Myokard.
Möglichkeiten
- Links- und rechtsventrikuläre Funktionsdiagnostik (Gold-Standard)
- Myokard-Diagnostik (Viabilität, Entzündung, Myopathie)
- Stress-MRI: Ischämiediagnostik (Regadenoson, Dobutamin)
- Darstellung von Klappenfunktion und -morphologie (Flussmessungen)
- Gefässdarstellung (z.B. vor Pulmonalvenenisolation)
- Perikarddiagnostik
Indikationen
- Identifikation des Ausmasses von infarziertem Myokard durch Anreicherung des Kontrastmittels Gadolinium in der Spätphase (Late Gadolinium Enhancement – LGE; Viabilitätsnachweis).
- Ischämiediagnostik
- Vitalitätsdiagnostik vor allfälliger Intervention/Bypass-Operation
- Komplexe kongenitale Vitien
- Entzündliche oder metabolische Herzmuskelerkrankungen
- Tumore
Limite
- Herzschrittmacher- und ICD-Träger (abhängig vom Modell)
- Mechanische Herzklappen, die vor 1980 implantiert wurden
- Herzrhythmusstörungen (Triggerprobleme)
Nuklearmedizinische Myokardperfusionsbildgebung: PET und SPECT
Technik
Die nuklearmedizinische Myokardperfusionsbildgebung erlaubt die Beurteilung der funktionellen Perfusion in Ruhe und unter Belastung und somit die Diagnose von Ischämien und Mykardnarben. Die Perfusionsdefekte werden semiquantitativ ausgewertet (gescored) und der Summed Difference Score (SDS) berechnet, was eine Risikostratifizierung erlaubt. Mit der Perfusions-PET (z.B. mit Rubidium-82) erfolgt zusätzlich eine Quantifizierung des myokardialen Blutflusses und der myokardialen Flussreserve, was zusätzlich eine Aussage über die Mikrozirkulation erlaubt. Ergänzt wird die Untersuchung durch die Bestimmung der koronaren Kalklast (Agatston-Score), was eine weitere Risikostratifizierung erlaubt. Die Untersuchung wird als Hybridbildgebung mit einem CT durchgefüht, so dass anatomische/morphologische und funktionelle Bildgebung kombiniert werden. Die Szintigrafie (SPECT) mit vorausgehender ergometrischer Belastung ist am KSSG für ausgewählte Fragestellungen (z.B. Ischämie bei malignem Koronaranomalien) verfügbar (höhere Strahlenbelastung).
Indikationen
- Ischämiediagnostik und -quantifizierung
- Risikostratifizierung (z.B. präoperativ)
- Calcium-Scoring zur Bestimmung der koronaren Kalklast
- Beurteilung der funktionellen Relevanz bei bekannten Koronarstenosen
Koronar-CT-Angiografie (Herz-CT)
Technik
Mit EKG-gesteuerter Zeitauflösung erreichen moderne Multislice-Computertomografen eine hohe örtliche Auflösung. Die Strahlenbelastung der Koronar-CT-Angiografie beträgt mit der modernen Technik ca. 0.5–5 mSv. Die Bestimmung der koronaren Kalklast erfolgt in einer nativen Niedrigdosis-CT von 0.2 mSv entsprechend dem Calcium-Score (Agatston-Score). Mit einmaliger Kontrastmittelgabe werden anschliessend der Koronarbaum und die intra-/extrakardiale Morphologie dargestellt sowie die linksventrikuläre Funktion berechnet. Die Untersuchungsdauer beträgt etwa 15 Min.
Möglichkeiten
- Ausschluss einer KHK bei tiefer/intermediärer Vortestwahrscheinlichkeit bis circa 15 % gemäss Tab. 1
- Beurteilung von Koronaranomalien
- Komplexe, angeborene Fehlbildungen
- Calcium-Scoring zur Bestimmung der koronaren Kalklast
- Der Calcium-Score quantifiziert die Menge an Verkalkung in den Koronararterien (Agatston-Score) und korreliert mit der Wahrscheinlichkeit des Vorliegens einer KHK.
Indikationen
- Bei einem selektionierten Patientengut (entsprechend Tab. 3)
- Präoperative Bildgebung der Koronarien vor valvulärer oder vitien-korrigierender Herzoperation
- Verdacht auf Koronaranomalie
Nicht indiziert
- Bei Hochrisikopatienten gemäss AGLA-Score und/oder hoher Vortestwahrscheinlichkeit gemäss Tab. 1
- Zur Verlaufsbeurteilung einer KHK
- Bei bestehenden komplexen Herzrhythmusstörungen
Die Koronarangiografie
Die Koronarangiografie ist in der Diagnostik der Koronaren Herzkrankheit (KHK) der Gold-Standard. Eine invasive Abklärung ist bei hochgradigem V. a. KHK und unbekanntem Koronarstatus in den meisten Fällen sinnvoll (siehe auch Abb 1. : Diagnostik bei AP und V.a. KHK). Indikationen für eine Koronarangiografie bzw. PCI oder Bypass-Operation (falls Koronarstatus schon bekannt) können mit dem Dienstarzt Kardiologie und den interventionell tätigen Kaderärzten intern besprochen werden. Anmeldungen für elektive Untersuchungen von extern sind an die ärztliche Leitung der Klinik für Kardiologie zu richten.
Therapie
Es werden zwei Ziele verfolgt:
- Verbesserung der Prognose durch Prävention von Myokardinfarkt, Herzinsuffizienz und Tod
- Reduktion der Symptome bzw. Verbesserung der Lebensqualität
Diese Ziele werden erreicht durch allgemeine nicht-medikamentöse Massnahmen, eine individualisierte medikamentöse Therapie sowie Revaskularisationseingriffe bei selektionierten Patienten. Voraussetzungen für eine angemessene Therapie sind eine adäquate Diagnostik und Risikostratifizierung mittels nicht-invasiver Methoden und meist Koronarangiografie.
Die Angriffspunkte der medikamentösen Therapie betreffen:
- Koronaratherosklerose: Verhinderung einer Progression bzw. eine Regression der Plaquelast und eine Plaque-Stabilisierung.
- «Umbauprozesse» des linken Ventrikels nach Infarkt (Remodeling): Verhinderung einer Progression einer linksventrikulären Dysfunktion und die Entwicklung einer Herzinsuffizienz.
- Myokardiale Ischämie: Reduktion von ischämischen Symptomen
Substanzen, die auf Ebene der Koronaratherosklerose und des Remodelings wirken und somit die Biologie des Krankheitsprozesses direkt beeinflussen, haben in der Regel einen prognostischen Nutzen, während dies für die antiischämisch wirksamen Medikamente nicht gilt (Ausnahme: Betablocker bei Postinfarkt-Patienten sowohl mit antiischämischer als auch Anti-Remodeling-Wirkung).
Die interventionelle (percutaneous coronary intervention; PCI) oder chirurgische (aortokoronarer Bypass) Revaskularisation stellt eine rein mechanische Therapie dar und benötigt ergänzend immer Lebensstilanpassungen (regelmässige körperliche Aktivität, Gewichtsreduktion, gesunde Ernährung, Nikotinabstinenz) und eine medikamentöse, sekundärpräventive Behandlung. Revaskularisationseingriffe sind sehr effektiv zur Linderung der Symptomatik, haben aber nur in bestimmten Konstellationen einen prognostischen Effekt.
Medikamentöse Therapien, welche die Koronaratherosklerose beeinflussen
Thrombozytenaggregationshemmer und orale Antikoagulation
- Aspirin 100 mg/Tag für alle Patienten mit KHK, bei Aspirin-Allergie Desensibilisierung in Erwägung ziehen
- Zusätzlich Clopidogrel (Plavix) 75 mg/Tag für 6 Monate nach PCI (Dauer in bestimmten Fällen weniger lang, muss in jedem Fall vom Interventionalisten genau festgelegt sein) und eventuell nach aortokoronarer Bypass-Operation. Bei stabiler KHK noch nicht genügend Daten zu Prasugrel und Ticagrelor; deshalb nur bei Kontraindikation für Clopidogrel einsetzen. Bei erhöhtem gastrointestinalem Blutungsrisiko Einsatz eines PPI, in erster Linie Pantoprazol (Pantozol) empfohlen.
- Bei hohem Ischämie- und vertretbarem Blutungsrisiko (PRECISE-DAPT-Score) kommt ein Jahr nach akutem Koronarsyndrom die Fortführung einer dualen Thrombozytenaggregationshemmung mit Aspirin niederig dosiert Ticagrelor (Brilique, 2×60 mg) in Frage.
- Orale Antikoagulation: Falls eine Indikation für eine orale Antikoagulation besteht (Vorhofflimmern, mechanische Klappenprothese, St. n. Lungenembolie u.a.), ist die orale Antikoagulation ohne Aspirin oft ausreichend; bei Risikopatienten mit stabiler KHK (insbesondere St. n. Stent) ist die Kombination von oraler Antikoagulation und Aspirin 100 mg/Tag zu erwägen. Die Datenlage ist diesbezüglich aber unklar; Vorgehen muss immer individuell (thrombotisches Risiko vs. Blutungsrisiko) diskutiert werden. Nach PCI wird die Dauer einer Triple Therapie (orale Antikoagulation kombiniert mit Aspirin und Clopidogrel) bzw. die Dauer der anschliessenden dualen Therapie (orale Antikoagulation kombiniert mit Clopidogrel) in Abhängigkeit vom thromboembolischen Risiko und vom Blutungsrisiko individuell festgelegt (Triple Therapie in der Regel ein Monat, maximal 6 Monate, dies aber nur in Ausnahmefällen) siehe Kapitel ACS Seite.
- Nicht-Vitamin K-Antagonisten-orale Antikoagulantien (NOAKs): Triple Therapie mit Aspirin und Clopidogrel nach PCI möglich (Dauer analog wie bei Vitamin K-Antagonisten, NOAK in der zur Verhinderung der Thromboembolie wirksamen Dosierung, festgelegt durch den Interventionalisten).
- Für Hochrisikopatienten kommt ausserhalb des Setting des akuten Koronarsyndroms eine Kombination aus Aspirin mit niedrig dosiertem Rivaroxaban (Xarelto, 2×2.5 mg) in Frage.
Lipid-modifizierende Therapie und SGLT2-Hemmer
- Grundsätzlich immer bei KHK, auch bei Cholesterinwerten im Ziel-Bereich (→ tiefe Dosis eines gut verträglichen Präparats)
- Primär Statine mit Ziel-LDL-Cholesterin < 1.4 mmol/l bzw. Halbierung des Ausgangswertes
- Zusätzlich Ezetimibe (Ezetrol) 10 mg möglich, senkt das LDL-Cholesterin zusätzlich und bringt zusätzlichen prognostischen Nutzen.
- Bempedoinsäure, PCSK9-Hemmer oder Inclisiran bei selektionierten Patienten → Siehe «Hyperlipidämien – Medikamentöse Therapie» Seite
- Für alle Diabetiker zusätzlich SGLT2-Hemmer siehe «Diabetes» Seite
Substanzen, die das linksventrikuläre Remodeling beeinflussen
- Nach durchgemachtem Herzinfarkt und eingeschränkter linksventrikulärer Auswurffraktion (left ventricular ejection fraction; LVEF < 40%) Betablocker und ACE-Hemmer; bei ACE-Hemmer Unverträglichkeit: Angiotensin-Rezeptor-Blocker. ACE-Hemmer auch ohne früheren Infarkt, falls nicht low risk (siehe nachfolgende Tabelle 4 Seite), insb. bei arterieller Hypertonie, aber nur lipophile ACE-Hemmer (Perindopril, Ramipril), da nur bei diesen Substanzen primär ein Effekt auf die Atherosklerose vermutet wird.
- Zusätzlich Eplerenon bei LVEF < 40% 3–14 Tage nach Myokardinfarkt und guter Background-Therapie (ACE-Hemmer und Betablocker); später nach Infarkt: LVEF < 35% und NYHA II → Eplerenon (Inspra), LVEF < 35% und NYHA ≥ III → Spironolacton (für weitere Details bezüglich Therapie der manifesten Herzinsuffizienz: siehe Kapitel «Herzinsuffizienz» Seite)
Medikamente mit günstigem Einfluss auf das LV-Remodelling
| Medikament und Dosis | Indikation | Kommentar |
ACE-Hemmer
|
|
|
ARB
|
Alternative zu ACE-Hemmer bei ACE-Hemmer-Intoleranz |
|
| Eplerenon: 25–50 mg | Früh (3-14 Tage) nach Myokardinfarkt und bei Vorliegen all der folgenden Bedingungen:
|
|
Betablocker
|
|
|
Antiischämische Therapie
Prinzip
Das Auftreten einer myokardialen Ischämie hängt von der Balance zwischen Sauerstoffzufuhr und -bedarf ab. Im Falle einer signifikanten Stenose ist die Zufuhr bzw. die Zufuhrreserve reduziert, sodass es bei einem Anstieg des Bedarfs im Rahmen körperlicher Belastung zu einer Ischämie kommt. Folgende Faktoren bestimmen den Sauerstoffbedarf des linken Ventrikels:
- Kontraktilität
- Herzfrequenz
- Wandspannung
Grundsätze der Behandlung
- Individualisierte Therapie
- Verschiedene Kombinationen möglich; Auswahl gemäss Wirkung und Nebenwirkungsprofil (siehe nachfolgende Tabelle 5 Seite)
- Die primäre Basistherapie besteht aus Betablocker und/oder Kalziumkanalblocker, wobei sich die Auswahl des Kalziumkanalblockers nach der Herzfrequenz richtet.
- Die Dosierung der einzelnen antianginösen Substanz sollte vor Ergänzung durch ein zweites Medikament zuerst nach oben titriert werden.
- Persistierende Beschwerden trotz antianginöser Zweiertherapie
können in der Regel durch den Zusatz einer dritten antianginösen Substanz nur noch wenig beeinflusst werden. Diese Patienten profitieren in der Regel von einer kathetertechnischen oder chirurgischen Revaskularisation, falls eine solche möglich ist.
Antiischämische Medikamente
| Medikament und Dosis | Indikation | Kommentar |
Betablocker
|
First-line Antianginosum |
|
Kalziumkanalblocker
|
|
|
Kurz wirksame Nitrate
Lang wirksame Nitrate
|
Behandlung des akuten Anfalls
Dauertherapie, Kombination mit anderen Antianginosa |
|
| Molsidomin: Retardierte Form, 2–3× 4 mg bis 2× 8 mg |
|
|
| Nicorandil: 2× 10–20 mg |
Add-on-Therapie, kann mit Nitraten und Molsidomin kombiniert werden |
|
| Ranolazin: 2× 375–750 mg |
Add-on-Therapie zu Betablocker (Cave: Sotalol wegen Interaktion), Amlodipin (Cave: Diltiazem, Verapamil wegen Interaktion), Nitraten |
|
| Ivabradin: 2× 2.5–7.5 mg |
Patienten im Sinusrhythmus, die Betablocker nicht tolerieren, bei denen Betablocker kontraindiziert sind oder bei denen Betablocker die Herzfrequenz ungenügend senken. Kann auch bei Patienten mit Herzinsuffizienz mit eingeschränkter LVEF eingesetzt werden
Vorsicht bei Patienten mit schwerer Angina (CCS 3): in dieser Situation Ausbau Betablockade und/oder Revaskularsation prüfen |
|
Invasive Therapie
Eine Revaskularisation muss bei Hinweisen auf eine mittelgrosse oder grosse myokardiale Ischämie (Revaskularisation aus prognostischen Gründen) und/oder bei fehlendem Ansprechen der Symptomatik auf eine medikamentöse antiischämische Therapie (symptomatische Indikation) erwogen werden.
Device-Therapie der therapierefraktären Angina bei Patienten ohne Revaskularisationsoptionen
Diese Therapien (Rückenmarksstimulation, Koronarsinus-Stent) sind noch in Entwicklung und nur in ausgewählten Einzelfällen eine Option.
Quellen/Links
- www.agla.ch
- Knuuti J et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41 (3):407–477. https://doi.org/10.1093/eurheartj/ehz425
- Fihn SD, Gardin JM, Abrams J et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease. J Am Coll Cardiol. 2012. 60;24:e44-e164; https://doi.org/10.1016/j.jacc.2012.07.013
Dr. Lucas Jörg
Prof. Dr. Dr. Flavio Forrer
Dr. Olaf Chan-Hi Kim
Dr. Sebastian Kopp
Prof. Dr. Sebastian Leschka
Prof. Dr. Micha Maeder
Prof. Dr. Hans Rickli