Tiefe Venenthrombose und Lungenembolie
Autorenteam Kantonsspital St.Gallen
Tiefe Venenthrombose (TVT)
Risikofaktoren
| Klassische hereditäre und erworbene Thrombophilien | |
| Faktor-V-Leiden (APC-Resistenz) | Antithrombin-III-Mangel |
| Prothrombin-G20210A-Mutation | Antiphospholipid-Syndrom |
| Protein-C-, Protein-S-Mangel | Positive Familienanamnese (erstgradig verwandt) |
| Paroxysmale nächtliche Hämoglobinurie (PNH) | Myeloproliferative Neoplasien (v.a. JAK2V617F-Mutation) |
| Risikofaktoren für thromboembolische Ereignisse | |
| Trauma/Operation | Apoplexie |
| Immobilisation | Myokardinfarkt, Herzinsuffizienz |
| Alter | Chronisch venöse Insuffizienz |
| Adipositas | Rauchen |
| Maligne Erkrankungen/Chemotherapie | Schwangerschaft/Wochenbett |
| Nephrotisches Syndrom | Orale Kontrazeptiva, Östrogentherapie |
| Liegende zentralvenöse und pulmonalarterielle Katheter | Hypervisköse Veränderungen (Polyzythämie, M. Waldenström) |
| Glukokortikoidtherapie | Langstreckenflug |
| St. nach TVT oder LE | Medikamente: Tamoxifen, Antipsychotika, Thalidomid u.v.a. |
Diagnostik der TVT
Vortestwahrscheinlichkeit für das Vorliegen einer TVT
Das Abschätzen der Vortestwahrscheinlichkeit ist unabdingbar zur Beurteilung der Diagnostik bei der TVT. Der Wells Score (Tab. 2) ist ein gebräuchliches Hilfsmittel dafür. Allerdings darf dieses im Vergleich zur integralen klinischen Beurteilung eines erfahrenen Arztes nicht überschätzt werden.
| Variable |
Punkte |
| Aktive Krebserkrankung |
+1 |
| Lähmung oder kürzliche Immobilisation der Beine |
+1 |
| Bettruhe (> 3 Tage), grosse Chirurgie in den letzten 12 Wochen |
+1 |
| Schmerz entlang der tiefen Venen |
+1 |
| Schwellung ganzes Bein |
+1 |
| Schwellung des Unterschenkels (> 3 cm Umfangsdifferenz) |
+1 |
| Eindrückbares Ödem am symptomatischen Bein |
+1 |
| Prominente Kollateralvenen |
+1 |
| Frühere, dokumentierte TVT |
+1 |
| Alternative Diagnose ebenso wahrscheinlich wie TVT |
–2 |
| ≥ 2 Punkte → hohe Wahrscheinlichkeit für TVT
< 2 Punkte → tiefe Wahrscheinlichkeit für TVT |
(28%) (6%) |
D-Dimer-Test bei TVT
Die empfindlichen D-Dimer-Tests (ELISA) eignen sich aufgrund ihrer hohen Sensitivität zum Ausschluss von Beinvenenthrombosen. Wegen der geringen Spezifität genügt ein positiver D-Dimer-Test nicht zum Nachweis eines thromboembolischen Geschehens. Der Grenzwert von 500 μg/l kann bei einem Alter über 50 Jahren mit der Formel Alter × 10 μg/l angepasst werden. Ein positiver D-Dimer-Test genügt auch in Kombination mit einer hohen Vortestwahrscheinlichkeit nicht für die Diagnose einer TVT, sondern es muss ein bildgebendes Verfahren angeschlossen werden. Generell wird bei hoher Vortestwahrscheinlichkeit direkt eine Bildgebung empfohlen.
Ein negativer D-Dimer-Test schliesst bei klinisch nicht hoher Vortestwahrscheinlichkeit eine tiefe Beinvenenthrombose mit hoher Wahrscheinlichkeit aus.
Kompressionsultraschall der Beinvenen bei TVT
Die Kompressionssonografie in den Händen eines geübten Untersuchers mit einem hochauflösenden Gerät ist heute das diagnostische Mittel der Wahl. Sie hat die Phlebografie als Gold-Standard zum Nachweis einer TVT abgelöst. Aus strahlenhygienischen Gründen besteht zudem heute keine Indikation für die Durchführung einer CT-Venografie der Beinvenen.

Therapie der tiefen Beinvenenthrombose (TVT)
Therapie der oberflächlichen Thrombophlebitis, Varikothrombose
Bei Befall von V. saphena magna oder parva wird eine Duplexsonografie auch der tiefen Venen empfohlen.
- Bei Thrombus nahe (< 3 cm) des tiefen Venensystems (z.B. Perforantes und insbesondere Mündung von V. saphena in V. femoralis communis oder V. poplitea [= Crosse]) erfolgt die Behandlung wie im Fall einer tiefen Venenthrombose. Bei Kontraindikation für Antikoagulation interdisziplinäre Besprechung.
- Bei ≥ 3 cm Entfernung vom tiefen Venensystem und Thrombuslänge ≥ 5 cm (v.a. im Bereich der supragenualen V. saphena magna und deren grösserer Seitenäste): Therapie mit Fondaparinux, NMH oder Rivaroxaban in prophylaktischer Dosierung für 45 Tage.
- Bei oberflächlicher Thrombophlebitis oder auch Thrombenbildung im tiefen venösen System im Rahmen von Eingriffen an den venösen Gefässen (z.B.: Sklerotherapie, endovenöse Interventionen) sollte die Therapie, Therapiedauer und Kontrolle mit der behandelnden Klinik abgestimmt werden.
Begleitend zur Antikoagulation sollte jeweils eine Kompressionsbehandlung bis zum Abklingen der Symptome erfolgen.
- Bei kleinem Befund (< 5 cm) und fern von Crosse/tiefem Venensystem: Kühlung, Kompression, NSAR lokal oder po und klinische Verlaufskontrolle.
Wiederholung der klinischen (und bei Bedarf sonographischen) Untersuchung nach 45 Tagen – oder bei Symptomverschlimmerung früher – zur Beurteilung des Beginns resp. einer Verlängerung der Antikoagulation und allenfalls Suche nach Malignom oder Hyperkoagulabilität.
Therapie der isolierten distalen Venenthrombose
Bei der isolierten distalen (unterhalb V. poplitea) TVT ohne Symptome und ohne Risikofaktoren für eine Progression (positiver D-Dimer-Test; Nähe zu proximalen Venen; Thrombose > 5 cm lang; mehrere Venen betreffend oder > 7 mm Durchmesser; kein auslösender Risikofaktor; persistierender, irreversibler Risikofaktor, wie z.B. eine aktive Krebserkrankung; Anamnese von TVT oder LE; Hospitalisation oder verlängerte Immobilisation) empfehlen wir serielle sonographische Verlaufskontrollen während 2 Wochen. Bei schweren Symptomen, Risikofaktoren für eine Ausdehnung oder sonographisch nachgewiesener Extension wird analog einer proximalen TVT behandelt.
Die Antikoagulationsdauer beträgt in der Regel jedoch nicht länger als 3 Monate (Ausnahmen diskutieren im Fall eines identifizierten und fortbestehenden Risikofaktors wie z.B. Antiphospholipid-Syndrom, aktive Tumorerkrankung).
Reine Muskelvenenthrombosen haben ein geringeres Extensionsrisiko, werden jedoch wie die distalen TVT behandelt. Schwere Symptome resp. Risikofaktoren für eine Progression (siehe oben) sprechen eher für eine Antikoagulation, ein hohes Blutungsrisiko dagegen.
Therapie der proximalen tiefen Beinvenenthrombose (TVT)
Bei der proximalen TVT unterscheidet sich die antithrombotische Therapie nicht von derjenigen von Lungenembolien. Zur Übersicht der medikamentösen Therapieoptionen siehe Seite ff.
Nur eine Phlegmasia coerulea dolens ist eine absolute Indikation für eine chirurgische oder kathetertechnische Thrombektomie oder eine Thrombolyse.
Relative Indikationen können deszendierende Beckenvenenthrombosen, optimalerweise mit erhaltenem venösem Zufluss über femoral, mit schwerer Symptomatik sein. Es profitieren in solchen Fällen primär jüngere Patienten mit möglichst kurz dauernder Symptomatik (maximal wenige Tage), gutem Allgemeinzustand und tiefem Blutungsrisiko von einer Thrombolyse.
Kompressionstherapie
Die Kompressionstherapie (initial mit Kurzzugbinden und nach Abschwellung mit Unterschenkel-Kompressionsstrümpfen der Klasse II) wird möglichst früh begonnen um längerfristig ein postthrombotisches Syndrom zu vermeiden. Die Dauer der Kompressionsbehandlung sollte sich daran orientieren, ob ein venöses Funktionsdefizit (mit vor allem Schwellungsneigung der Beine) fortbesteht und wie allfällige phlebologische Kontrolluntersuchungen (evt. nach 3-6 Monaten und dann in 6-12 monatigen Intervallen) ausfallen.
Mobilisation
Lungenembolie (LE)
Die Mortalität liegt ohne Behandlung um 30%, mit Behandlung bei 2–11%.
Das Risiko für die Entwicklung einer chronischen thromboembolischen pulmonal-arteriellen Hypertonie (CTEPH) nach unprovozierten Lungenembolien beträgt ca. 1.5%.
Zusammenhang zwischen TVT und LE
Ca. 90% der LE sind Folge einer TVT (Autopsiebefunde). Bei akuten, symptomatischen Lungenembolien finden sich mittels Kompressionsultraschall nur in 30–50% (–70%) Beinvenenthrombosen. Dieser Nachweis ist aber mit einer erhöhten Mortalität assoziiert.
Risikofaktoren für LE
Die Risikofaktoren entsprechen denjenigen für TVT (siehe Tab. 1).
Diagnostik der LE
Beurteilung der klinischen Stabilität
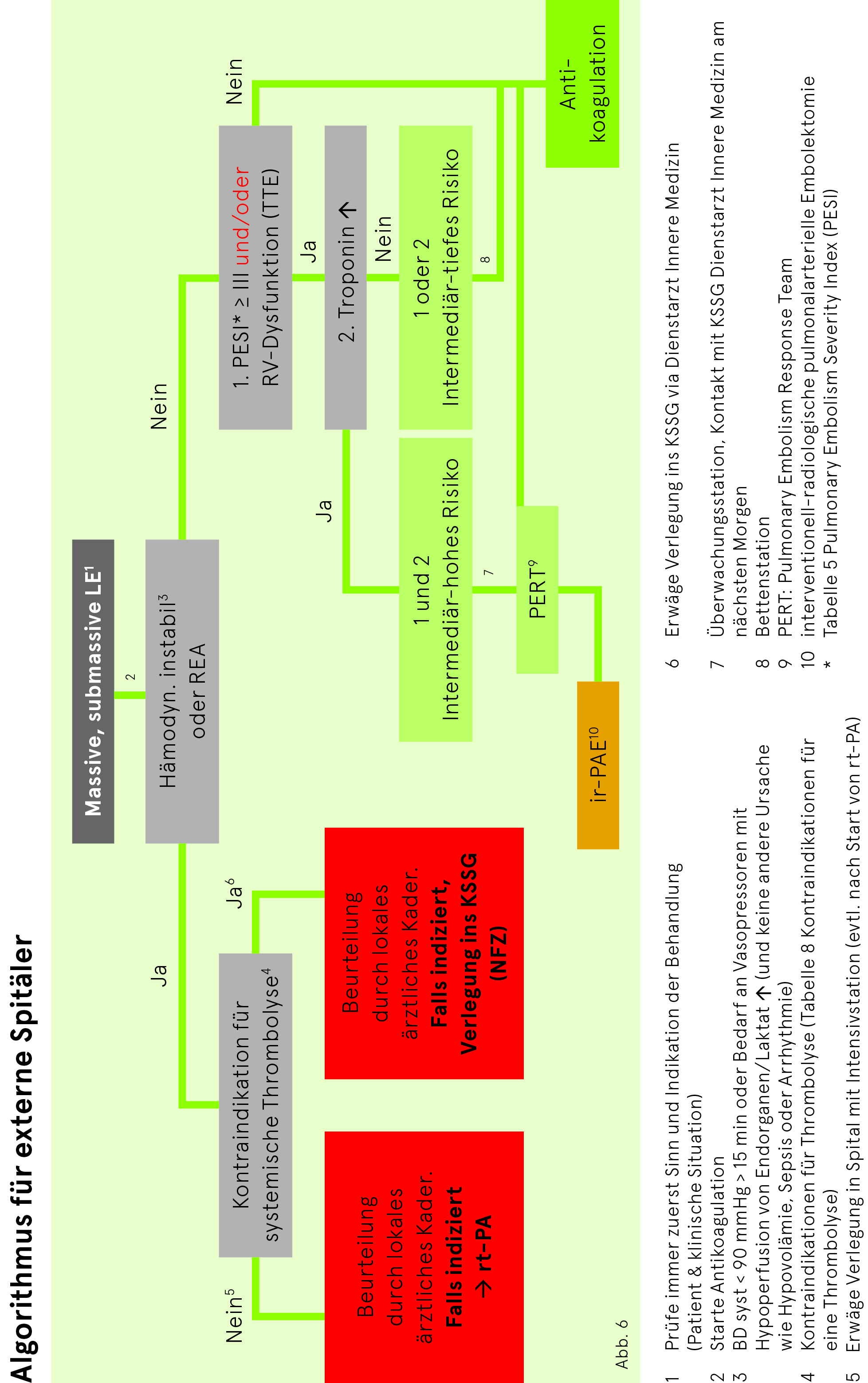
Bei Verdacht auf LE muss als erster Schritt evaluiert werden, ob der Patient im Schock ist und damit gemäss der Abb. 3 vorgegangen werden muss. In solchen Fällen ist die Vortestwahrscheinlichkeit per se schon hoch. Stabile Patienten werden gemäss Abb. 4 abgeklärt.
Vortestwahrscheinlichkeit
Die Bestimmung der Vortestwahrscheinlichkeit mit dem modifizierten Genfer Score oder dem Wells Score (Tab. 3) ist zusammen mit der Erfassung der klinischen Gesamtsituation unabdingbar zur Beurteilung der Diagnostik bei LE.
| Modifizierter Genfer Score | Wells-Score | ||
| Variable | Punkte | Variable | Punkte |
| Alter > 65 Jahre | +1 | ||
| Frühere TVT oder LE | +3 | Frühere TVT oder LE | +1.5 |
| Operation oder Fraktur im letzten Monat | +2 | Frische Operation oder Immobilisation | +1.5 |
| Aktive Krebserkrankung | +2 | Krebserkrankung | +1 |
| Einseitige Beinschmerzen | +3 | ||
| Hämoptyse | +2 | Hämoptyse | +1 |
| Herzfrequenz 75–94/Min. | +3 | +1.5 | |
| Herzfrequenz ≥ 95/Min. | +5 | Herzfrequenz > 100/Min. | |
| Schmerz bei Palpation der tiefen Beinvenen und einseitiges Ödem | +4 | Klinische Zeichen einer TVT | +3 |
| Alternative Diagnose unwahrscheinlicher als LE | +3 | ||
| Klinische Wahrscheinlichkeit | Klinische Wahrscheinlichkeit | ||
| Niedrig (8%) | 0–3 | Niedrig (3%) | 0–1 |
| Mittel (28%) | 4–10 | Mittel (28%) | 2–6 |
| Hoch (74%) | ≥ 11 | Hoch (78%) | ≥ 7 |
D-Dimer-Test bei LE
Der D-Dimer-Test eignet sich aufgrund seiner hohen Sensitivität und der geringen Spezifität nur zum Ausschluss von Lungenembolien. Der Grenzwert von 500 μg/l kann bei einem Alter über 50 Jahren mit der Formel Alter × 10 µg/l angepasst werden.
Ein negativer D-Dimer-Test schliesst bei tiefer und mittlerer Vortestwahrscheinlichkeit eine LE mit klinisch genügender Sicherheit aus.
Eine hohe Vortestwahrscheinlichkeit und ein positiver D-Dimer-Test genügen nicht für die Diagnose einer LE. Bei hoher Vortestwahrscheinlichkeit wird von der Durchführung des D-Dimer-Tests abgeraten und direkt ein bildgebendes Verfahren empfohlen.
Kompressionsultraschall der Beinvenen bei Verdacht auf LE
Der Nachweis einer tiefen Beinvenenthrombose genügt bei entsprechenden Symptomen zum Nachweis von Lungenembolien. Mit Durchführung eines Kompressionsultraschalls vor dem Lungenembolie-CT können ca. 10% der CTs gespart werden.
Lungenembolie-Computertomografie (LE-CT)
Heute ist die CT der Gold-Standard zum Nachweis oder Ausschluss von segmentalen oder proximalen Lungenembolien (negativer Vorhersagewert ca. 99%). Moderne Mehrzeilen-CT erlauben zunehmend die Diagnose von isolierten subsegmentalen Lungenembolien.
Ventilation-/Perfusion-SPECT/CT
Diese Untersuchungsmethode kommt bei Kontraindikationen (schwere Niereninsuffizienz, manifeste Hyperthyreose, Anaphylaxie auf KM) für eine LE-CT oder Schwangerschaft und unauffälligem konventionellem Röntgenbild der Lunge in Frage.
Ein normales Perfusionsverteilungsmuster schliesst Lungenembolien mit klinisch genügender Wahrscheinlichkeit aus (negativer Vorhersagewert = negative predictive value 97 – 99%). Limitierend sind Lungengerüsterkrankungen (z.B. bei COPD, Lungenemphysem), die ein Ventilations-/Perfusions-Mismatch verbergen können.
Die Ventilations-Perfusions-SPECT/CT hat eine höhere Sensitivität als die LE-CT für kleine peripher okkludierende Embolien, sodass bei der chronischen pulmonal-arteriellen Hypertonie mit Frage nach rezidivierenden, peripheren Lungenembolien die Ventilations-/Perusions-SPECT/CT das Mittel der Wahl ist.
Risikostratifizierung bei LE
| Risikomarker | |||||
| frühes Mortalitätsrisiko | Schock oder Hypotonie | PESI-Klasse III – V | Rechtsventrikuläre Dysfunktion (Echo, CT) | Kardiale Biomarker (BNP, Troponin) | Therapieimplikationen |
| Hoch > 15% | + | (+) | + | (+) | Thrombolyse oder Embolektomie |
| Intermediär hoch | – | + | + | + | Hospitalisation, Rescue Reperfusion bei Verschlechterung |
| Intermediär tief | – | + | +
– – |
–
+ – |
Hospitalisation, Rescue Reperfusion bei Verschlechterung |
| Tief < 1% | – | – | – | – | |
Faktoren, die bei der Beurteilung des Risikos helfen, sind in Tab. 4 aufgelistet.
Liegt keine hämodynamische Instabilität (Abb. 3) vor, bei der eine möglichst rasche Wiedereröffnung der Pulmonalarterien dringlich ist, empfiehlt sich die Berechnung des PESI-Scores (Tab. 5). und ein Vorgehen nach Abb. 4. Bei hohem und intermediär hohem Risiko ist eine Echokardiografie durchzuführen. Bei einem intermediär tiefen Risiko sollte eine Echokardiografie in den ersten Tagen der Hospitalisation durchgeführt werden.


| Merkmale | Punkte |
| Alter | +1/Jahr |
| Männliches Geschlecht | +10 |
| Krebs in der persönlichen Anamnese | +30 |
| Herzinsuffizienz | +10 |
| Chronische Atemwegserkrankung | +10 |
| Herzfrequenz ≥ 110 pro Min. | +20 |
| Systolischer arterieller Blutdruck < 100 mmHg | +30 |
| Atemfrequenz ≥ 30 pro Min. | +20 |
| Temperatur < 36 ºC | +20 |
| Störung des Bewusstseins (Desorientiertheit, Lethargie, Stupor o. Koma) | +60 |
| Arterielle Sauerstoffsättigung < 90% | +20 |
| Der Gesamtscore wird durch Addition der Punktezahlen der vorliegenden klinischen Merkmale gebildet. |
| Punkte | Klasse | 30-Tage-Mortalität |
| ≤ 65 | Klasse I | 0.0–1.6% |
| 66–85 | Klasse II | 1.7–3.5% |
| 86–105 | Klasse III | 3. 2–7.1% |
| 106–125 | Klasse IV | 4.0–11.4% |
| ≥ 126 | Klasse V | 10.0–24.5% |
Therapie der LE
Bei hämodynamischer Instabilität ist eine dringende, rasche Wiedereröffnung (mittels Thrombolyse, kathetertechnischer Fragmentierung oder Embolektomie) der Pulmonalarterien die allenfalls lebensrettende Massnahme.
Bei weniger schweren Fällen geht es in erster Linie um eine rasch zu beginnende Antikoagulation zur Verhinderung der Progression des thrombotischen Prozesses und zur Verhinderung von Rezidiven.
Antithrombotische Therapie bei TVT und LE
| Substanz | Dosierung |
| Enoxaparin (Clexane) sc | 1 mg/kg (2×/Tag) oder 1.5 mg/kg (1×/Tag) |
| Heparin iv | Bolus 80 E/kgKG
Startgeschwindigkeit Infusion 18 E/kgKG/Std.; Weitere Anpassungen nach Labor* Stopp, wenn INR an zwei Tagen ≥ 2.0 |
| Bei Heparin-induzierter Thrombopenie (HIT)**
Argatroban (Argatra) iv |
Gemäss Merkblatt «Argatroban (Argatra)» der Gruppe für Arzneimitteltherapiesicherheit des KSSG |
| Bei Heparin-induzierter Thrombopenie (HIT)**
Fondaparinux (Arixtra) sc |
KG < 50 kg: 5 mg/Tag sc
KG 50-100 kg: 7.5 mg/Tag sc KG > 100 kg: 10 mg/Tag sc |
| Phenprocoumon (Marcoumar) | Beginn gleichentags Stunden nach Beginn von Heparin oder NMH bis INR ≥ 2.0, anschliessend 1×/Tag gemäss INR, Ziel-INR 2.5 (2.0–3.0) |
| Rivaroxaban (Xarelto) | 15 mg (2×/Tag für 3 Wochen; kein zusätzliches Heparin oder NMH), dann 20 mg (1×/Tag) |
| Apixaban (Eliquis) | 10 mg (2×/Tag für 7 Tage; kein zusätzliches Heparin oder NMH), dann 5 mg (2×/Tag) |
| Edoxaban (Lixiana) | Initial mind. 5 Tage Heparin/NMH, dann 60 mg (1×/Tag) |
| Dabigatran (Pradaxa) | Initial mind. 5 Tage Heparin/NMH, dann 150 mg (2×/Tag) |
Bei hoher Vortestwahrscheinlichkeit für eine LE wird die Therapie (Heparin-Bolus, 1. Dosis des NMH oder NOAK [Apixaban, Rivaroxaban]) vor der Vervollständigung der Diagnostik eingeleitet.
Bei unfraktioniertem Heparin (UFH) und niedermolekularem Heparin (NMH) ist eine regelmässige Thrombozytenkontrolle (z.B. am Tag 0, 5, 7, 9) notwendig wegen der Möglichkeit einer Heparin-induzierten Thrombopenie (HIT).
Bei Niereninsuffizienz (geschätzte, absolute (nicht auf eine Körperoberfläche von 1.73 m2 normierte) glomeruläre Filtrationsrate eGFR < 30 ml/min), schwerem Übergewicht oder geplanter Reperfusion wird die labor-gesteuerte[1], kontinuierliche Gabe von unfraktioniertem Heparin empfohlen. Bei allen Patienten ist immer das Blutungsrisiko unter Antikoagulation gegen das Thromboembolierisiko ohne Antikoagulation abzuwägen.
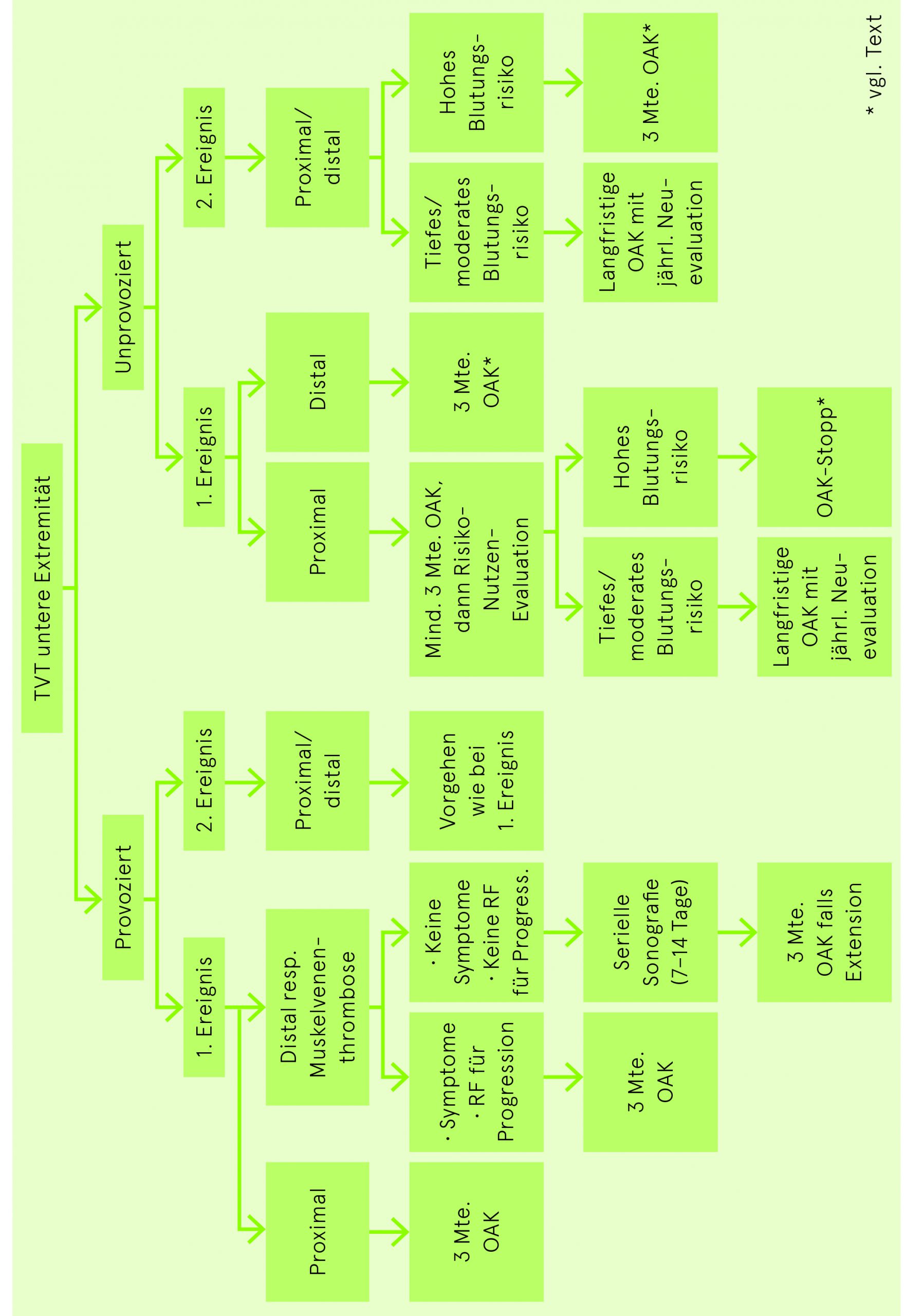
Bei hohem Blutungsrisiko nach einem ersten oder zweiten unprovozierten thromboembolischen Ereignis, das eine Fortführung der voll dosierten Antikoagulation über drei Monate hinaus nicht rechtfertigt, ist Apixaban (2× 2.5 mg/Tag) oder Rivaroxaban (1× 10 mg/Tag) gegenüber keiner antithrombotischen Therapie abzuwägen.
| Erstes Ereignis | Dauer |
| Transienter Risikofaktor (z.B. Operation) | 3 Monate |
| Unprovozierte Genese – TVT isoliert distal | Sonographisches Follow up während 2 Wochen oder OAK für 3 Monate (siehe Text) |
| Unprovozierte Genese – TVT proximal oder LE | 3 Monate, anschliessend gemäss Blutungsrisiko |
|
Zeitlich unbegrenzt
In der Regel begrenzt auf 3 Monate |
| Bei aktiver Krebskrankheit | |
|
Zeitlich unbegrenzt (mindestens solange maligne Erkrankung aktiv) |
| Antiphospholipid-Antikörper-Syndrom | Rücksprache mit Hämostaseologen |
| Rezidiv (TVT und LE) | Dauer |
| Unprovozierte Genese | Zeitlich unbegrenzt |
Behandlung der subsegmentale Lungenembolien
Bei Patienten mit subsegmentalen Lungenembolien (ohne Beteiligung von proximalen Lungenarterien und ohne proximale TVT), die ein tiefes Rezidivrisiko für eine Thromboembolie haben, kann unter gewissen Voraussetzungen auf eine antithrombotische Therapie verzichtet werden. Beim Verzicht auf eine Antikoagulation dürfen folgende Risikofaktoren nicht vorliegen: Hospitalisation oder reduzierte Mobilität, aktives Krebsleiden, nicht reversible Risikofaktoren für Thromboembolie, geringe kardiopulmonale Reserve oder deutliche Symptome, die nicht anders erklärt werden können. Eine serielle Phlebosonografie der Beine ist bei Verzicht auf eine antithrombotische Therapie zu erwägen. Ein hohes Blutungsrisiko spricht eher gegen eine Antikoagulation.
Thrombolyse
Ein Schock mit nachgewiesener rechtsventrikulärer Dysfunktion ist eine klare Indikation für eine Thrombolyse. Die Vollantikoagulation mit Heparin wird gleichzeitig eingeleitet.
Gelegentlich wird bei gutem hämodynamischen Ansprechen und/oder hohem Blutungsrisiko nur die halbe Dosis des Thrombolytikums verabreicht. Eine Rescue-Thrombolyse ist bei hämodynamischer Verschlechterung bis 14 Tage nach initialem Ereignis möglich. Beim Nachweis von mobilen rechtsventrikulären Thromben muss eine Thrombolyse resp. eine kathetertechnische oder chirurgische Embolektomie erwogen werden.
| Absolute Kontraindikationen |
| Hämorrhagischer Schlaganfall |
| Ischämischer Schlaganfall in den letzten 3 Monaten |
| Hirntumor und Hirnmetastasen |
| Grösseres Trauma, grössere Operation, Schädelhirntrauma in den letzten 3 Wochen |
| Gastrointestinale Blutung im letzten Monat |
| Bekanntes Blutungsrisiko |
| Relative Kontraindikationen |
| TIA in den letzten 6 Monaten |
| Orale Antikoagulation |
| Schwangerschaft (bis 1 Woche postpartal) |
| Nicht komprimierbare Punktionsstellen |
| Traumatische Reanimation |
| Therapierefraktäre Hypertonie (> 180/110 mmHg) |
| Infektiöse Endokarditis |
| Fortgeschrittene Lebererkrankung |
| Aktives peptisches Ulkus |
| Alteplase (Actilyse) |
| 10 mg iv als Bolus, dann 90 mg iv über 2 Std. (falls Gewicht < 65 kg: Gesamtdosis 1.5 mg/kg iv: 10 mg als Bolus, Rest über 2 Std.) |
Kathetertechnische Behandlung der Lungenembolie
Eine kathetertechnische Behandlung einer Lungenembolie kann bei Patienten der Risikogruppen «hoch» und «intermediär-hoch» evaluiert werden (siehe Tab. 4).
Bei hämodynamisch instabilen Patienten (Risikogruppe «hoch») mit Kontraindikationen für eine Thrombolyse ist – bei vorhandener Therapieindikation – eine schnellstmögliche Avisierung der Anästhesie (NFZ) bzw. Intensivisten vorzunehmen und die kathetertechnische Behandlung durch die interventionelle Radiologie sowie die anschliessende Betreuung auf der Intensivstation zu planen.
Patienten mit intermediär-hohem Risiko sind per definitionem kreislaufstabil, haben jedoch eine nachgewiesene Rechtsherzbelastung (TTE) und ein erhöhtes Troponin. Hier werden durch den Eingriff Surrogatparameter verbessert. Studien mit harten Endpunkten (Mortalität) fehlen noch. In ausgewählten Fällen kann bei intermediär-hohem Risiko eine kathetertechnische Therapie von Lungenembolien erwogen werden. Über die Durchführung des Eingriffs entscheidet das interdisziplinäre PERT (pulmonary embolism response team; bestehend aus Kaderärzten Allgemeine Innere Medizin, MIPS, Kardiologie, Interventionelle Radiologie).
Die Dokumentation der formalen Risikostratifizierung (Vitalparameter inkl. Temperatur und Atemfrequenz, Befund Echokardiografie, PESI-Score), der Entscheidungsfindung und des Entscheids ist Sache der behandelnden Klinik. Für den Fall einer weiteren Verschlechterung muss vor dem Eingriff die Fragen: 1) Mechanische Reanimation, 2) Intubation, 3) ECMO-Einlage zwingend geklärt und dokumentiert werden.
Da die Patienten gemäss Definition stabil sind, geschehen Entscheidungsfindung und Eingriff tagsüber. Während des Eingriffes werden Patienten von den Fachärzten der Anästhesie oder der zuständigen Intensivstation mitbehandelt. Die Terminabsprache erfolgt zwischen der interventionellen Radiologie und der Anästhesie (respektive Intensivstation).
Notwendige Vorbereitungen vor kathetertechnischer Thrombektomie:
- Heparin wird für den Eingriff nicht gestoppt oder dosisreduziert
- Notwendige Laboranalysen: Chemie (Natrium, Kalium, Harnstoff, Kreatinin), Blutbild (Hämatogramm II), Gerinnung (INR, Fibrinogen, D-Dimere), Blutgruppe, Testblut
- Bildgebung: CT-Angiografie (Thorax, evtl. zusätzlich abdomino-pelvin)

Implantation eines Filters in die Vena cava inferior
Die Einlage eines Cava-Filters kann indiziert sein bei absoluter Kontraindikation für eine Antikoagulation, bei rezidivierenden LE trotz suffizienter OAK, bei einem Polytrauma mit hohem Thromboembolierisiko, ausnahmsweise perioperativ bei frischer TVT und erhöhtem Blutungsrisiko mit passagerer Kontraindikation für eine Antikoagulation.
Bettruhe
Bei hämodynamisch stabilen Patienten ohne rechtsventrikuläre Dysfunktion ist keine Immobilisierung erforderlich. Sobald eine rechtsventrikuläre Dysfunktion vorliegt, soll in den ersten Tagen eine Überwachung unter stationären Bedingungen erfolgen; ggf. bei «gelockerter» Bettruhe.
Weiterführende Diagnostik
Malignomsuche
Bei einer unprovozierten Thrombose oder Lungenembolie wird in 3–15% ein Malignom gefunden. Eine beschränkte diesbezügliche Diagnostik (Anamnese, klinische Untersuchung, Routine-Hämatologie und -Chemie) wird empfohlen, wobei jedoch nicht nachgewiesen ist, dass dadurch Morbidität oder Mortalität gesenkt werden kann. Allenfalls Vervollständigung der anerkannten primärpräventiven Untersuchungen (Mammografie, gynäkologische Untersuchung, PAP-Abstrich, Koloskopie usw.). Weiterführende Diagnostik (Thorax-Röntgen, Abdomensonografie, CT, Endoskopien, Tumormarker usw.) nur bei entsprechenden Verdachtsmomenten, insbesondere bei jüngeren Patienten nach Ausschluss einer Thrombophilie.
Gerinnungsabklärung/Thrombophilie-Abklärung
Akutabklärung
- Bei familiärer Belastung mit Antithrombin- oder Protein-C-Mangel (hier ist eine Substitution zu erwägen: Beizug eines Spezialisten)
- Bei einer erneuten Thrombose unter unfraktioniertem Heparin oder NMH muss sofort eine HIT gesucht werden.
Abklärung idealerweise ungefähr 3 Monate nach dem Ereignis, falls
- Thromboembolie ohne ersichtlichen Grund und Alter < 50 Jahre
- Rezidivierende Thromboembolien
- Familiäre Belastung mit Thromboembolien
- Thrombosen an ungewöhnlichen Orten
- Neue Thromboembolie unter Antikoagulation
- Thromboembolie während der Schwangerschaft oder unter oralem Kontrazeptivum
- Thromboembolie und Abortneigung
Generell sollten in der Akutphase einer Thromboembolie keine funktionellen Untersuchungen erfolgen, da die zu untersuchenden Gerinnungsfaktoren durch die Thromboembolie verbraucht werden können und dies dann ohnehin eine zweite Untersuchung notwendig macht (Ausnahme AT-III-Bestimmung bei hohem Heparin-Bedarf). Genetische Tests können unter Heparinisierung, NOAKs und Vitamin K-Antagonisten durchgeführt werden, jedoch sind diese deutlich teurer als die funktionellen Screening-Methoden.
Gerinnungsanalysen nach Beendigung der oralen Antikoagulation
APC-Resistenz und/oder Faktor-V-Leiden, Prothrombin-Genmutation G20210A, Protein C-Aktivität, Protein S-Aktivität, Antithrombin-Aktivität, Lupus Antikoagulans, Anticardiolipin-Antikörper, anti-beta-2-Glykoprotein-Antikörper, paroxysmale nächtliche Hämoglobinurie (falls Zytopenien, erhöhtes MCV, Hämolysezeichen), myeloproliferative Syndrome (z.B. mittels NGS-Panel) bei entsprechenden Blutbildveränderungen (Polyglobulie, Thrombozytose, Leukozytose). Suche nach JAK2V617F-Mutation bei splanchnischer oder zerebraler Venenthrombose auch bei normalem Blutbild. Bei einem initial normalen Protein-C-System-Test kann auf die Bestimmung von Protein C und von der APC-Resistenz bzw. die Suche nach einer Faktor-V-Leiden-Mutation verzichtet werden.
Für diese Untersuchungen empfehlen wir die Zuweisung an einen Spezialisten (Hämostaseologe/Hämatologe).
3 Monate Antikoagulation → Thrombophiliescreening → Entscheidung bezüglich Dauer der Antikoagulation (sofern nicht schon aufgrund von Klinik und Anamnese klar)
Bei relevant erhöhtem Risiko für ein Rezidiv (unprovozierte thromboembolische Ereignisse)
Vitamin K-Antagonist (Phenprocoumon oder Acenocoumarol) wird abgesetzt und nach Abfall der INR < 2 wird eine Thromboseprophylaxe begonnen (z.B. mit 1× täglich Enoxaparin [Clexane] 1 mg/kgKG sc oder allenfalls NOAK). Nach 3 Wochen wird das niedermolekulare Heparin gestoppt, am Tag nach dem Stopp erfolgt die Blutentnahme für die Thrombophilie-Abklärung (bei Niereninsuffizienz muss im Zweifelsfall die Anti-Xa-Aktivität – zum Nachweis der fehlenden NMH-Wirkung – bestimmt werden). Dann Wiederaufnahme der Prophylaxe bis zum Vorliegen der Laborresultate und Festlegen des weiteren Prozederes.
NOAK werden 36–48 Std. vor der Thrombophilieabklärung pausiert und können gleich anschliessend wieder gestartet werden bis zur Festlegung des definitiven Procederes. Für diese Abklärungen empfehlen wir die Zuweisung an einen Hämatologen/Hämostaseologen.
Spezielle Situationen
Rechtsventrikuläre Thromben
Bei echokardiografischem Nachweis von flottierenden Thromben im rechten Ventrikel (mit einer hohen frühen Letalität) wird eine Thrombolyse oder Embolektomie empfohlen.
Schwangerschaft
Die Inzidenz thromboembolischer Ereignisse beträgt 0.76 bis 1.72 pro 1000 Schwangerschaften. Der D-Dimer-Test ist in der Schwangerschaft physiologisch (leicht) erhöht und hilft deshalb nur weiter, wenn er nicht erhöht ist. Mit einem D-Dimer-Test von < 1’000 µg/l und fehlenden YEARS-Kriterien (klin. Zeichen einer TVT, Hämoptoe, LE wahrscheinlichste Diagnose) kann eine LE ausgeschlossen werden. Bei einem D-Dimer-Test von 500 µg/l kann auch bei vorhandenen YEARS-Kriterien eine LE ausgeschlossen werden. Trifft keine der beiden vorgenannten Situationen zu, so wird die Durchführung eines LE-CTs empfohlen. Zur Diagnose resp. zum Ausschluss einer LE kann bei Bedarf und nach Ausschöpfen der sonographischen Möglichkeiten (Phlebosonografie) auch ein LE-CT – ohne signifikantes Risiko für den Fötus und Mutter – durchgeführt werden. Während der Schwangerschaft Therapie mit NMH oder Heparin, postpartal mit Phenprocoumon (Marcoumar, auch bei Stillen erlaubt) für mind. 3 Monate.
Maligne Erkrankungen
Bei Malignomen treten gehäuft thromboembolische Ereignisse auf.
Hier kommen therapeutisch NMH oder orale direkte Xa-Inhibitoren in Betracht.
Bei Patienten ohne erhöhtes gastrointestinales Blutungsrisiko kann die Antikoagulation mit einem der zugelassenen oralen direkten Xa-Inhibitoren in üblicher Dosierung erfolgen, bei der Verwendung von Edoxaban und Dabigatran initial Therapie mit NMH oder UFH für mindestens 5 Tage notwendig. Dies gilt nur für Patienten mit einem guten Performance Status (ECOG < 3). Im Vergleich zu den NMH zeigen die NOAKs tendenziell einen besseren Schutz vor Rezidivereignissen bei allerdings leicht erhöhtem Blutungsrisiko, insbesondere im gastrointestinalen Bereich bei entsprechender Prädisposition.
Armvenenthrombose bei Zentralvenenkatheter oder Port-à-Cath
Antithrombotische Therapie wie bei TVT. Funktionierende, korrekt liegende, nicht infizierte Katheter können weiter benutzt werden. Weiterführung der antithrombotischen Therapie, solange ZVK oder Port-à-Cath in situ und 6–12 Wochen über die Entfernung derselben hinaus.
Rechtsventriklärer Dysfunktion
Wird im LE-CT oder in der Echokardiografie eine rechtsventrikuläre Dysfunktion festgestellt, dann empfiehlt sich eine Verlaufsechokardiografie nach 3 bis 6 Monaten hinsichtlich Entwicklung einer chronischen thromboembolischen pulmonalen Hypertonie (CTEPH).
Dr. Alexander Böhler
Dr. Enrique Alejandre-Lafont
Dr. Ulf Benecke
Dr. Lukas Graf
Dr. Lukas Kern
Dr. Gian-Reto Kleger
Dr. Joachim Müller
Prof. Dr. Hans Rickli
Dr. Jörg Scheler
- Steuerung im KSSG nach PiCT, in anderen Spitälern nach aPTT, Anti-Faktor-Xa-Aktivität etc. ↵
